ぬり薬の蘊蓄 第4章 ぬり薬を評価するために:生物学的同等性試験について
外用剤の生物学的同等性試験には、皮膚薬物動態学的試験、薬理学的試験、残存量試験、薬物動態学的試験、臨床試験、in vitro 効力試験、動物試験の7つが示されています。生物学的同等性の評価は、薬物および製剤の特性にあわせて、科学的妥当性が担保できる方法を選択して実施します。
1. 皮膚薬物動態学的試験
外用剤を皮膚に適用後、定常状態において、角質層内に存在する薬物量から生物学的同等性を評価する試験です。作用部位が角質層内または角質層より深部にある薬物を含有する製剤に適用されます。液状または半固形状の製剤において、本試験により生物学的同等性を適切に評価し得るのは、原則として試験製剤が標準製剤と同一の剤形区分であり、かつ基剤の性状が同じ場合です。
2. 薬理学的試験
外用剤を適用することにより生じる薬理学的反応を測定して、生物学的同等性を評価する試験です。
コルチコステロイドの場合は、血管収縮作用による皮膚の蒼白化反応の強度を指標にして生物学的同等性を評価できます。ただし、作用の弱いコルチコステロイドでは蒼白化反応が弱く、指標にできないことがあります。
蒼白化反応の測定方法には、製剤を適用した部分の色と適用していない周辺部分の色との差を4または5段階にスコア化して、熟練した測定者が蒼白化の程度を判定する視覚的方法と、色差計を用いて蒼白化反応を評価する方法があります。
3. 残存量試験
皮膚に適用された後の製剤中に残存する薬物量から、皮膚に分布した薬物量を推定する試験です。極端に経皮吸収性が低い製剤などでは、皮膚に残存する薬物量から分布量を推定し、製剤間の差を正確に評価することが難しいため、この試験は適していません。
4. 薬物動態学的試験
製剤を適用した後の薬物の血中濃度を測定し、薬物動態パラメータから生物学的同等性を評価する試験です。薬物の作用部位が角質層内または角質層より下部あるいはその両方にあり、薬効または作用部位濃度と薬物動態が良い相関を示す場合に有用な方法です。
5. 臨床試験
薬理効果または臨床効果を指標として生物学的同等性を評価する試験です。薬物に応じて治療効果に関連する適切な評価項目を選択し、統計学的に同等性を評価し得る被験者数で試験を行う必要があります。統計学的な同等性評価を要する場合、薬物毎に適切な同等性の許容域を設定し、標準製剤と試験製剤の薬理効果または臨床効果の同等性を判定します。
6. In vitro 効力試験
In vitro における効力を指標として生物学的同等性を評価する試験です。作用部位が皮膚表面にあるか、または患部が表面に表れている場合に使用する殺菌・消毒剤などで、薬効を発揮するために薬物が角質層を透過する必要がない場合に実施します。薬物毎に適切な同等性の許容域を設定し、標準製剤と試験製剤の効力の同等性を判定します。
7. 動物試験
製剤を適用することにより動物の皮膚表面に生じる薬理学的反応を指標として、生物学的同等性を評価する試験です。止血剤、殺菌・消毒剤、創傷治癒促進剤など、薬物の作用部位が皮膚表面にあり、薬効を発揮するために薬物が角質層を透過する必要がない場合に実施します。薬物毎に適切な同等性の許容域を設定し、標準製剤と試験製剤の効力の同等性を判定します。
以上、7つの生物学的同等性試験を概説しました。
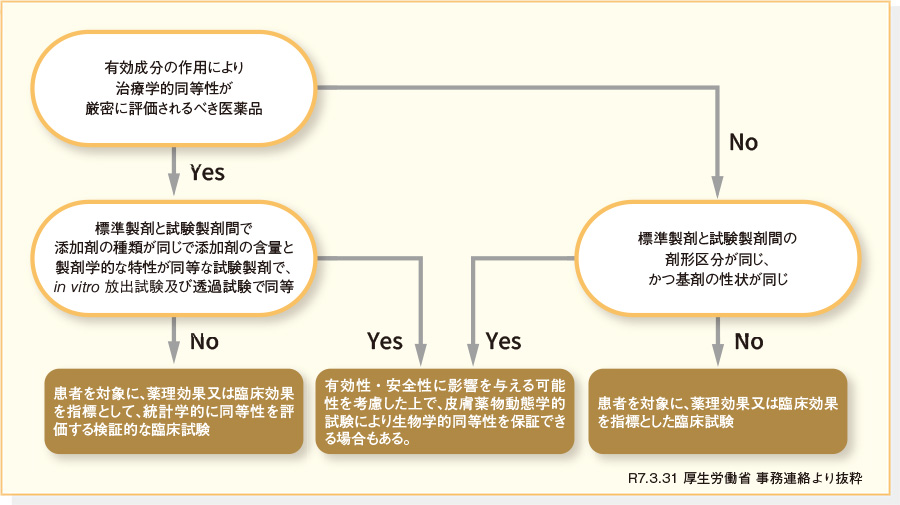
液状または半固形状の局所皮膚適用製剤では、製剤間における基剤をはじめとする添加剤や物理化学的特性(粘度、展延性、稠度、主薬の粒子状態等)の差異が有効成分の吸収と皮膚内の移行に複雑な影響を及ぼすため、適切な評価方法の選択と試験条件の設定が重要です。液状または半固形状の製剤のうち、治療学的同等性が厳密に評価されるべき医薬品においては、患者を対象に、薬理効果または臨床効果を指標として、統計学的に同等性を評価する検証的な臨床試験を実施することが基本となります。ただし、標準製剤と添加剤の種類が同じで、添加剤の量と製剤学的な特性(粘度、エマルジョン構造、粒度分布、pH、密度等)が同等な試験製剤で、in vitro 試験(放出試験及び透過試験)で同等である場合には、上記以外の特性が有効性・安全性に影響を与える可能性を考慮した上で、皮膚薬物動態学的試験により生物学的同等性を保証できる場合もあります。
治療学的同等性が厳密に評価されるべき医薬品に該当しない液状または半固形状の製剤については、標準製剤と試験製剤間の剤形区分が同じで基剤の性状(油性、水性、乳剤性〔W/O型、O/W型〕など)も同じ場合は、生物学的同等性の評価法として有効成分の特性に合わせて皮膚薬物動態学的試験を選択することができます。標準製剤と試験製剤間の剤形区分が異なる場合、または同じ剤形区分で基剤の性状が異なる場合には、生物学的同等性評価において、患者を対象に、薬理効果または臨床効果を指標とした臨床試験の実施が必要です。
参考:液状または半固形状の局所皮膚適用製剤の生物学的同等性試験の進め方