ミチーガの主要な副作用:皮膚症状の悪化
アトピー性皮膚炎患者を対象とした国内臨床試験及び結節性痒疹患者を対象とした国内臨床試験において、原病変(アトピー性皮膚炎又は結節性痒疹)の悪化が認められました。また、原病変の悪化とは異なる皮膚症状として、アトピー性皮膚炎患者では浮腫性紅斑、結節性痒疹患者では浮腫性紅斑及び湿疹等が認められました。これら、ミチーガ投与後に発現する可能性のある皮膚症状を統合し、「皮膚症状の悪化」として定義し、医薬品リスク管理計画書(RMP)において重要な特定されたリスクと設定しています1)。
ミチーガ投与後に浮腫性紅斑、湿疹等の発現を含む、皮膚症状の悪化が認められています2,3)。ミチーガ投与中は患者の状態を十分に観察し、これらの症状が発現した場合には、適切な処置を行ってください4)。
RMP設定理由
臨床試験において、アトピー性皮膚炎の悪化、浮腫性紅斑、湿疹等の皮膚症状の悪化及び発現がプラセボ群と比較し本剤群で多く認められたことから、皮膚症状の悪化を重要な特定されたリスクとしました1)。
発現状況
国内臨床試験での発現状況
60mgシリンジ13歳以上のアトピー性皮膚炎患者を対象とした国内プラセボ対照第III相試験(M525101-01試験)の盲検投与期間1)
| 因果関係を問わない有害事象 | 因果関係が否定できない有害事象 | |||
|---|---|---|---|---|
| ミチーガ群(143例) n(%) |
プラセボ群(72例) n(%) |
ミチーガ群(143例) n(%) |
プラセボ群(72例) n(%) |
|
| 皮膚症状の悪化 | 41(28.7) | 18(25.0) | 29(20.3) | 5(6.9) |
30mgバイアル6歳以上13歳未満のアトピー性皮膚炎患者を対象とした国内第Ⅲ相試験(M525101-04試験)の盲検投与期間1)
| 因果関係を問わない有害事象 | 因果関係が否定できない有害事象 | |||
|---|---|---|---|---|
| ミチーガ群(46例) n(%) |
プラセボ群(43例) n(%) |
ミチーガ群(46例) n(%) |
プラセボ群(43例) n(%) |
|
| 皮膚症状の悪化 | 9(19.6) | 7(16.3) | 4(8.7) | 0(0) |
30mgバイアル13歳以上の結節性痒疹患者を対象とした国内第Ⅱ/Ⅲ相試験(M525101-11試験)の盲検投与期間1)
ミチーガとの因果関係を問わない皮膚症状の悪化は、ミチーガ投与群77例中31例(40.3%)、プラセボ群76例中17例(22.4%)であり、そのうち、ミチーガとの因果関係が否定できない有害事象は、ミチーガ投与群19例(24.7%)、プラセボ群5例(6.6%)でした。このうちミチーガとの因果関係を問わない結節性痒疹の悪化は、ミチーガ投与群7例(9.1%)、プラセボ群12例(15.8%)であり、そのうち、ミチーガとの因果関係が否定できない有害事象でも、ミチーガ投与群2例(2.6%)、プラセボ群5例(6.6%)と、ミチーガ群よりもプラセボ群で発現割合が高く認められました。
そのため、結節性痒疹の悪化を除いて、皮膚症状の悪化の発現割合を算出すると、ミチーガ投与群27例(35.1%)、プラセボ群7例(9.2%)であり、そのうち、ミチーガとの因果関係が否定できない有害事象は、ミチーガ投与群17例(22.1%)で、プラセボ群では報告されませんでした。また、全期間を通してミチーガとの因果関係が否定できない重篤な有害事象は報告されませんでした。
アトピー性皮膚炎の悪化及び原病変とは特徴の異なる皮膚症状の発現を合わせて「皮膚症状の悪化」と定義して集計した。「皮膚症状の悪化」はアトピー性皮膚炎、異汗性湿疹、貨幣状湿疹、紅斑、湿疹、水疱、中毒性皮疹、剥脱性皮膚炎、全身性剥脱性皮膚炎、皮膚びらん、皮膚炎、皮膚剥脱、丘疹、丘疹性皮疹、手皮膚炎、薬疹、皮膚乾燥、発疹、紅斑性皮疹、乾皮症、表皮肥厚、ざ瘡様皮膚炎、環状紅斑、結節性紅斑、ばら色粃糠疹、剥脱性発疹、多形紅斑、酒さ、汗疹、皮脂欠乏性湿疹、脂漏性皮膚炎、神経皮膚炎、過角化、皮膚潰瘍、円形脱毛症、皮膚嚢腫、稗粒腫、爪の障害、爪肥厚、紫斑、丘疹落屑性皮疹、皮膚亀裂、皮脂欠乏症、苔癬様角化症、皮膚腫瘤、びまん性脱毛症(いずれもPT)と定義した。結節性痒疹の悪化は、PT:神経皮膚炎として集計されている4)。
なお、以降の集計には結節性痒疹の悪化(PT:神経皮膚炎)は集計には含んでいない。
処置、転帰(重症度別)
60mgシリンジ13歳以上のアトピー性皮膚炎患者を対象とした国内第Ⅲ相試験(M525101-01試験及びM525101-02試験)4)
| 重症度*1 | 処置 | 抗炎症剤治療 | 件数 (n=189*2) |
転帰 |
|---|---|---|---|---|
| 軽度 | 128(67.7%) | |||
| 継続 | 111 | |||
| strongクラスTCS | 5 | 回復4件、未回復1件 | ||
| very strongクラスTCS | 40 | 回復36件、軽快2件、未回復2件 | ||
| strongestクラスTCS | 12 | 回復12件 | ||
| 経口剤a) | 2 | 回復2件 | ||
| その他b) | 52 | 回復43件、軽快3件、未回復6件 | ||
| 休薬 | 2 | |||
| strongestクラスTCS | 1 | 回復1件 | ||
| その他b) | 1 | 回復1件 | ||
| 投与中止 | 3 | |||
| very strongクラスTCS | 1 | 未回復1件 | ||
| 経口剤a) | 1 | 未回復1件 | ||
| その他b) | 1 | 軽快1件 | ||
| 非該当*3 | 12 | |||
| strongクラスTCS | 3 | 回復1件、未回復2件 | ||
| very strongクラスTCS | 1 | 未回復1件 | ||
| strongestクラスTCS | 1 | 未回復1件 | ||
| その他b) | 7 | 回復2件、軽快1件、未回復4件 | ||
| 中等度 | 60(31.7%) | |||
| 継続 | 45 | |||
| strongクラスTCS | 2 | 回復2件 | ||
| very strongクラスTCS | 18 | 回復17件、未回復1件 | ||
| strongestクラスTCS | 10 | 回復9件、未回復1件 | ||
| 経口剤a) | 5 | 回復5件 | ||
| その他b) | 10 | 回復10件 | ||
| 休薬 | 5 | |||
| very strongクラスTCS | 2 | 回復2件 | ||
| strongestクラスTCS | 1 | 未回復1件 | ||
| 経口剤a) | 1 | 軽快1件 | ||
| その他b) | 1 | 回復1件 | ||
| 投与中止 | 8 | |||
| strongクラスTCS | 1 | 未回復1件 | ||
| very strongクラスTCS | 3 | 回復1件、未回復2件 | ||
| 経口剤a) | 3 | 回復1件、軽快1件、未回復1件 | ||
| その他b) | 1 | 未回復1件 | ||
| 非該当*3 | 2 | |||
| strongクラスTCS | 1 | 未回復1件 | ||
| 経口剤a) | 1 | 未回復1件 | ||
| 高度 | 1(0.5%) | |||
| 継続 | 1 | |||
| その他b) | 1 | 回復1件 |
a)免疫抑制剤、内服ステロイド剤 b)使用なしを含む
*1 軽度:不快感はあるが、通常の日常生活には支障をきたさない程度のもの 中等度:不快感が日常生活を制限するか、あるいは通常の日常生活に影響するほどに大きい 高度:仕事あるいは通常の日常生活を行えない
*2 ミチーガ投与中に認められた皮膚症状の悪化(ミチーガとの因果関係を問わない有害事象)(PT:神経皮膚炎を除く)
*3 規定されている治験薬の投与が全て終了した後に有害事象が発現した場合
TCS:ステロイド外用剤
30mgバイアル6歳以上13歳未満のアトピー性皮膚炎患者を対象とした国内第Ⅲ相試験(M525101-04試験)4)
| 重症度*1 | 処置 | 抗炎症剤治療 | 件数 (n=52*2) |
転帰 |
|---|---|---|---|---|
| 軽度 | 42(80.8%) | |||
| 継続 | 35 | |||
| strongクラスTCS | 18 | 回復17件、軽快1件 | ||
| very strongクラスTCS | 7 | 回復7件 | ||
| その他b) | 10 | 回復10件 | ||
| 休薬 | 3 | |||
| strongクラスTCS | 2 | 回復2件 | ||
| very strongクラスTCS | 1 | 軽快1件 | ||
| 非該当*3 | 4 | |||
| strongクラスTCS | 1 | 回復1件 | ||
| very strongクラスTCS | 1 | 軽快1件 | ||
| その他b) | 2 | 回復1件、未回復1件 | ||
| 中等度 | 10(19.2%) | |||
| 継続 | 8 | |||
| strongクラスTCS | 1 | 回復1件 | ||
| very strongクラスTCS | 7 | 回復5件、軽快2件 | ||
| 投与中止 | 1 | |||
| strongクラスTCS | 1 | 未回復1件 | ||
| 非該当*3 | 1 | |||
| very strongクラスTCS | 1 | 未回復1件 | ||
| 高度 | 0 |
b)使用なしを含む
*1 軽度:不快感はあるが、通常の日常生活には支障をきたさない程度のもの 中等度:不快感が日常生活を制限するか、あるいは通常の日常生活に影響するほどに大きい 高度:仕事あるいは通常の日常生活を行えない
*2 ミチーガ投与中に認められた皮膚症状の悪化(ミチーガとの因果関係を問わない有害事象)(PT:神経皮膚炎を除く)
*3 規定されている治験薬の投与が全て終了した後に有害事象が発現した場合
TCS:ステロイド外用剤
30mgバイアル13歳以上の結節性痒疹患者を対象とした国内第Ⅱ/Ⅲ相試験(M525101-11試験)4)
| 重症度*1 | 処置 | 抗炎症剤治療 | 件数 (n=104*2) |
転帰 |
|---|---|---|---|---|
| 軽度 | 90(86.5%) | |||
| 継続 | 78 | |||
| strongクラスTCS | 18 | 回復14件、軽快3件、未回復1件 | ||
| very strongクラスTCS | 23 | 回復16件、軽快4件、未回復3件 | ||
| strongestクラスTCS | 7 | 回復6件、軽快1件 | ||
| その他b) | 30 | 回復25件、軽快3件、未回復2件 | ||
| 休薬 | 6 | |||
| very strongクラスTCS | 1 | 回復1件 | ||
| strongestクラスTCS | 2 | 回復2件 | ||
| その他b) | 3 | 回復2件、未回復1件 | ||
| 投与中止 | 1 | |||
| 経口剤a) | 1 | 軽快1件 | ||
| 非該当*3 | 5 | |||
| strongクラスTCS | 3 | 回復3件 | ||
| その他b) | 2 | 未回復2件 | ||
| 中等度 | 13(12.5%) | |||
| 継続 | 7 | |||
| strongクラスTCS | 1 | 軽快1件 | ||
| very strongクラスTCS | 4 | 回復3件、未回復1件 | ||
| strongestクラスTCS | 1 | 回復1件 | ||
| その他b) | 1 | 回復1件 | ||
| 休薬 | 1 | |||
| strongestクラスTCS | 1 | 軽快1件 | ||
| 投与中止 | 3 | |||
| strongestクラスTCS | 1 | 回復1件 | ||
| 経口剤a) | 2 | 回復1件、軽快1件 | ||
| 非該当*3 | 2 | |||
| strongクラスTCS | 1 | 回復1件 | ||
| very strongクラスTCS | 1 | 軽快1件 | ||
| 高度 | 1(1.0%) | |||
| 休薬 | 1 | |||
| very strongクラスTCS | 1 | 回復1件 |
a)免疫抑制剤、内服ステロイド剤 b)使用なしを含む
*1 軽度:不快感はあるが、通常の日常生活には支障をきたさない程度のもの 中等度:不快感が日常生活を制限するか、あるいは通常の日常生活に影響するほどに大きい 高度:仕事あるいは通常の日常生活を行えない
*2 ミチーガ投与中に認められた皮膚症状の悪化(ミチーガとの因果関係を問わない有害事象)(PT:神経皮膚炎を除く)
*3 規定されている治験薬の投与が全て終了した後に有害事象が発現した場合、または他の有害事象により休薬されている期間に発現し、回復した場合
TCS:ステロイド外用剤
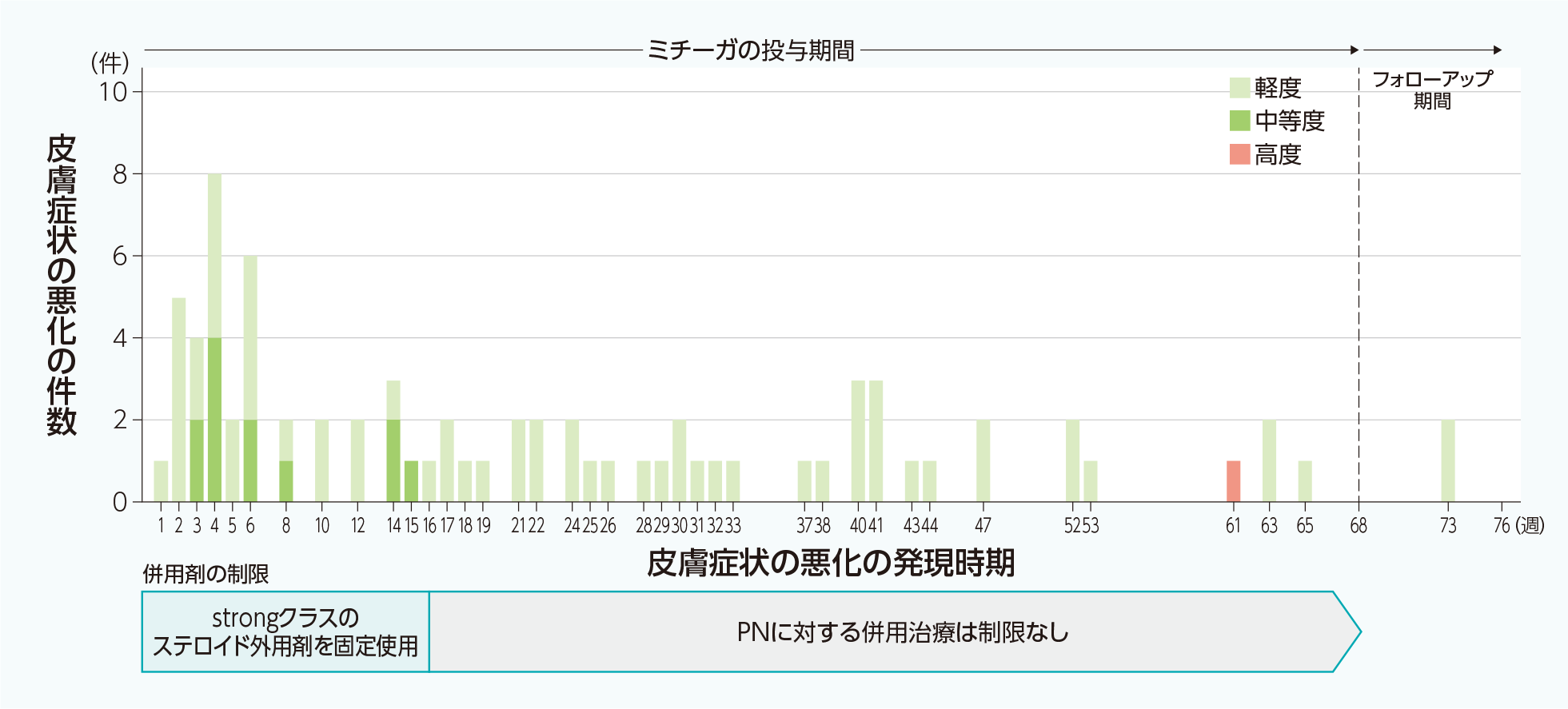
発現時期
下図中の重篤度についての定義は以下のとおりです。なお、ミチーガの投与中に認められた皮膚症状の悪化(ミチーガとの因果関係を問わない有害事象)の集計に結節性痒疹の悪化(PT:神経皮膚炎)は含んでいません。
軽度:不快感はあるが、通常の日常生活には支障をきたさない程度のもの
中等度:不快感が日常生活を制限するか、あるいは通常の日常生活に影響するほどに大きい
高度:仕事あるいは通常の日常生活を行えない
60mgシリンジ13歳以上のアトピー性皮膚炎患者を対象とした国内第Ⅲ相試験(M525101-01試験)4)
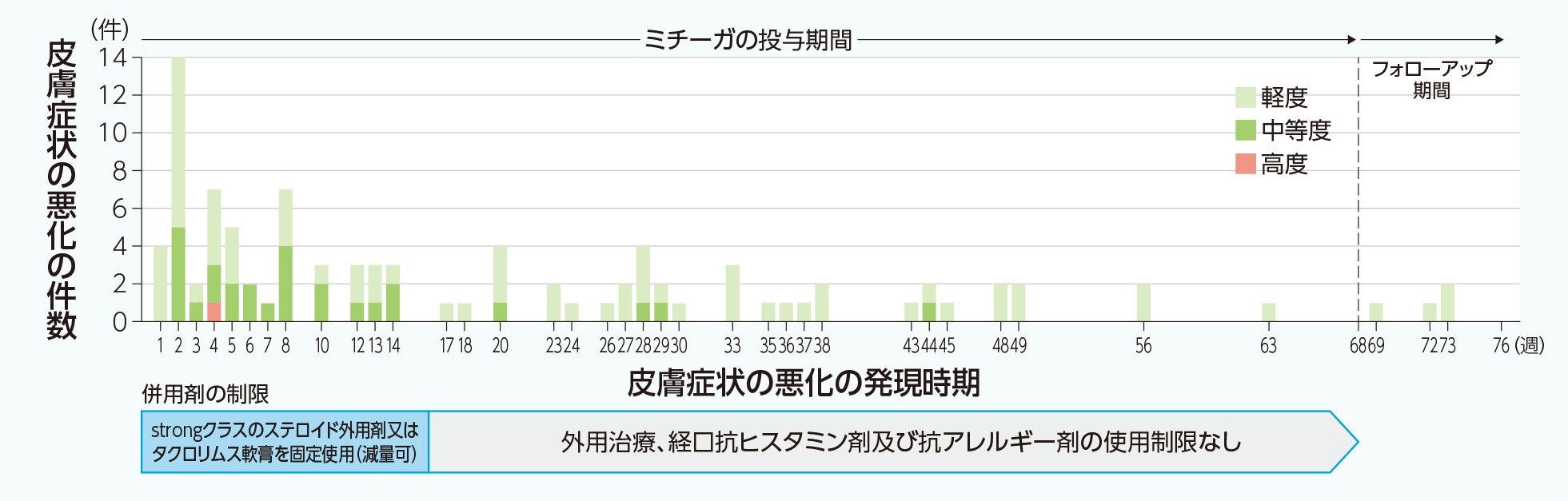
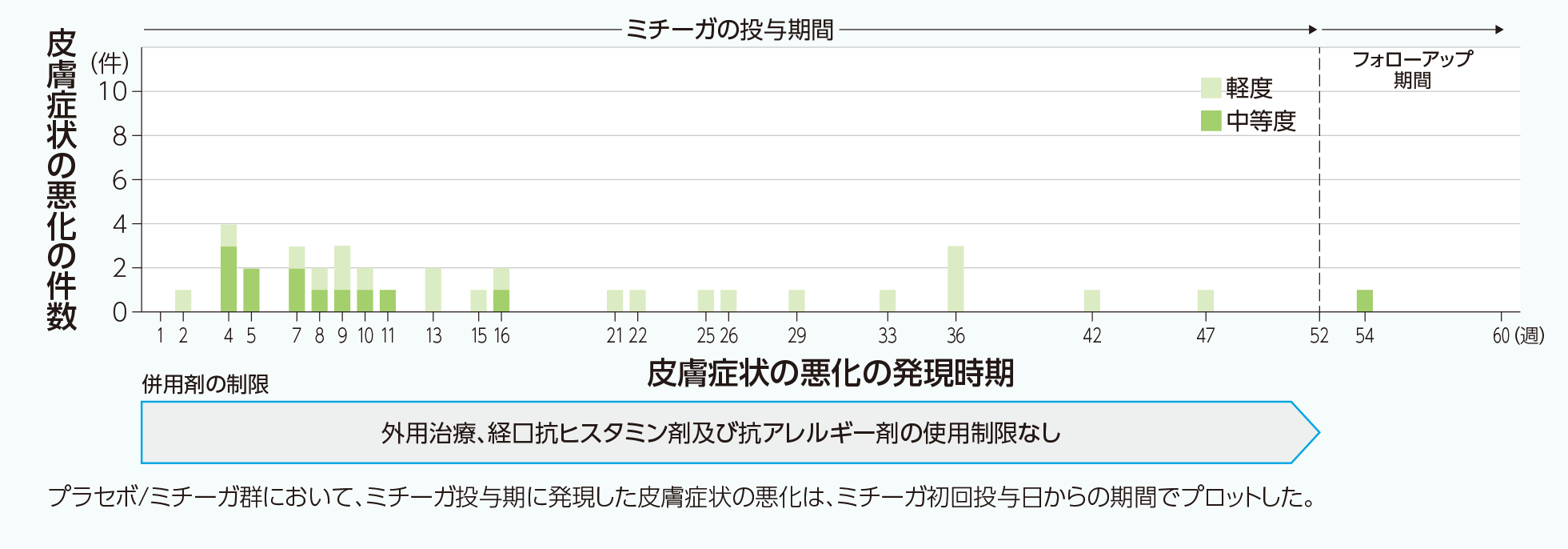
60mgシリンジ13歳以上のアトピー性皮膚炎患者を対象とした国内長期投与試験(M525101-02試験)4)
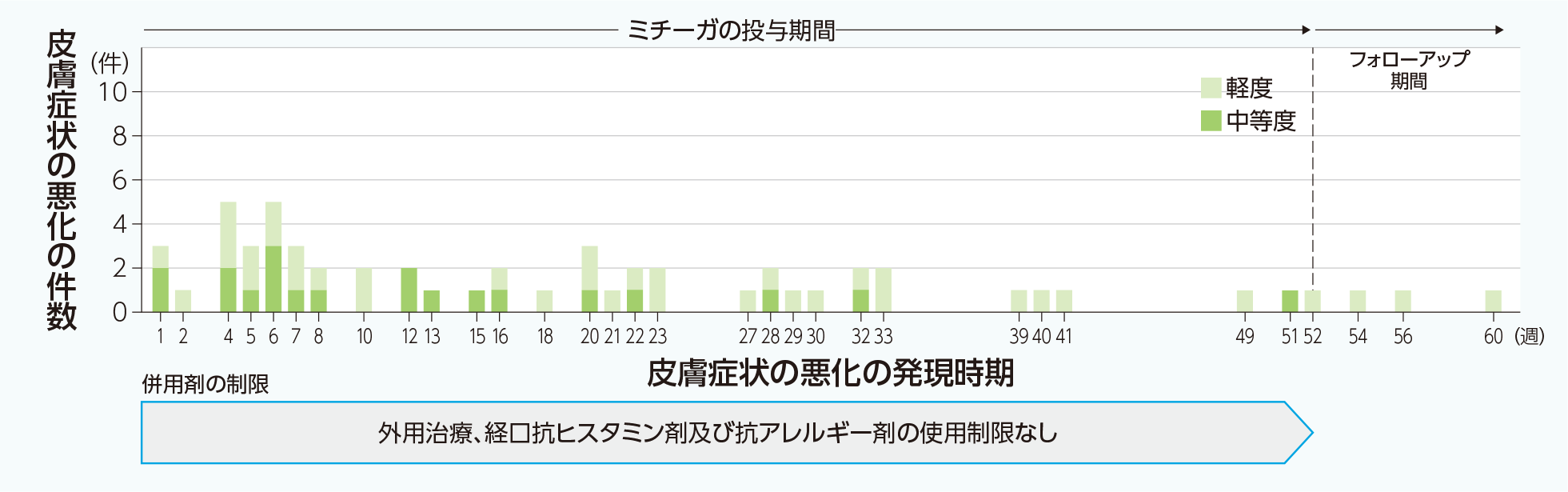
30mgバイアル6歳以上13歳未満のアトピー性皮膚炎患者を対象とした国内第Ⅲ相試験(M525101-04試験)4)
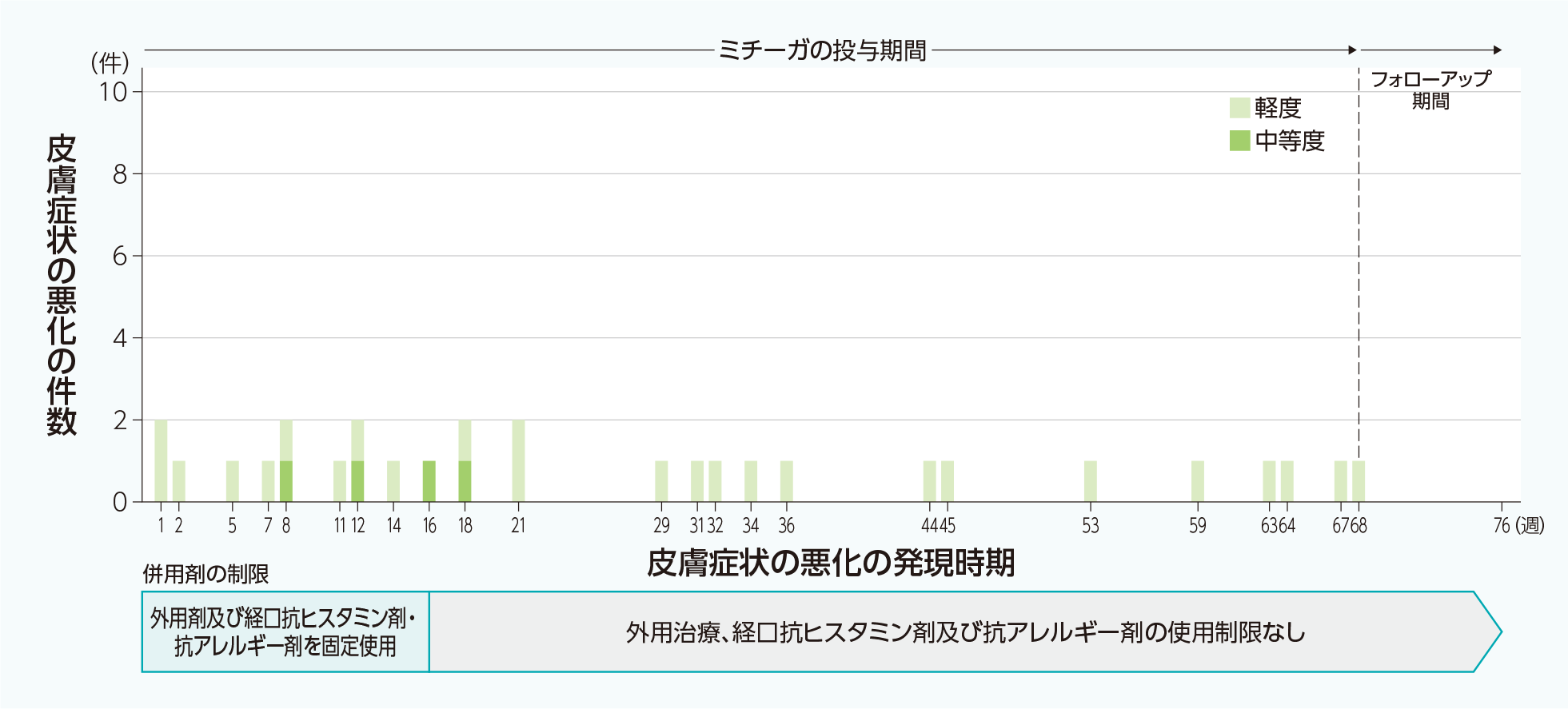
30mgバイアル13歳以上の結節性痒疹患者を対象とした国内第Ⅱ/Ⅲ相試験(M525101-11試験)4)
皮膚症状の悪化の発現から回復までの期間
| 試験 | 国内第Ⅲ相試験 (M525101-01試験) |
国内長期投与試験(M525101-02試験) | 国内第Ⅲ相試験(M525101-04試験) | 国内第Ⅱ/Ⅲ相試験(M525101-11試験) |
|---|---|---|---|---|
| 対象患者 | 13歳以上の アトピー性皮膚炎患者 |
13歳以上の アトピー性皮膚炎患者 |
6歳以上13歳未満の アトピー性皮膚炎患者 |
13歳以上の 結節性痒疹患者 |
| 投与 | ミチーガ60mg | ミチーガ60mg | ミチーガ30mg | ミチーガ30mg ※初回は60mg投与 |
| 解析対象集団 例数 |
210 | 88 | 89 | 112 |
| 皮膚症状の 悪化(件) |
131 | 58 | 52 | 104 |
| ~28日 29~56日 57~84日 85日~ |
28(21.4%) 15(11.5%) 14(10.7%) 54(41.2%) |
5(8.6%) 11(19.0%) 13(22.4%) 11(19.0%) |
10(19.2%) 10(19.2%) 5(9.6%) 19(36.5%) |
17(16.3%) 21(20.2%) 6(5.8%) 34(32.7%) |
ミチーガ投与中に認められた皮膚症状の悪化(ミチーガとの因果関係を問わない有害事象)(PT:神経皮膚炎を除く)4)
各期間の割合の分母は皮膚症状の悪化の発現件数を用いた。
転帰が「軽快」、「未回復」、「回復したが後遺症あり」、「死亡」、「不明」の皮膚症状の悪化(PN悪化を除く)は回復までの期間毎の集計から除外した。
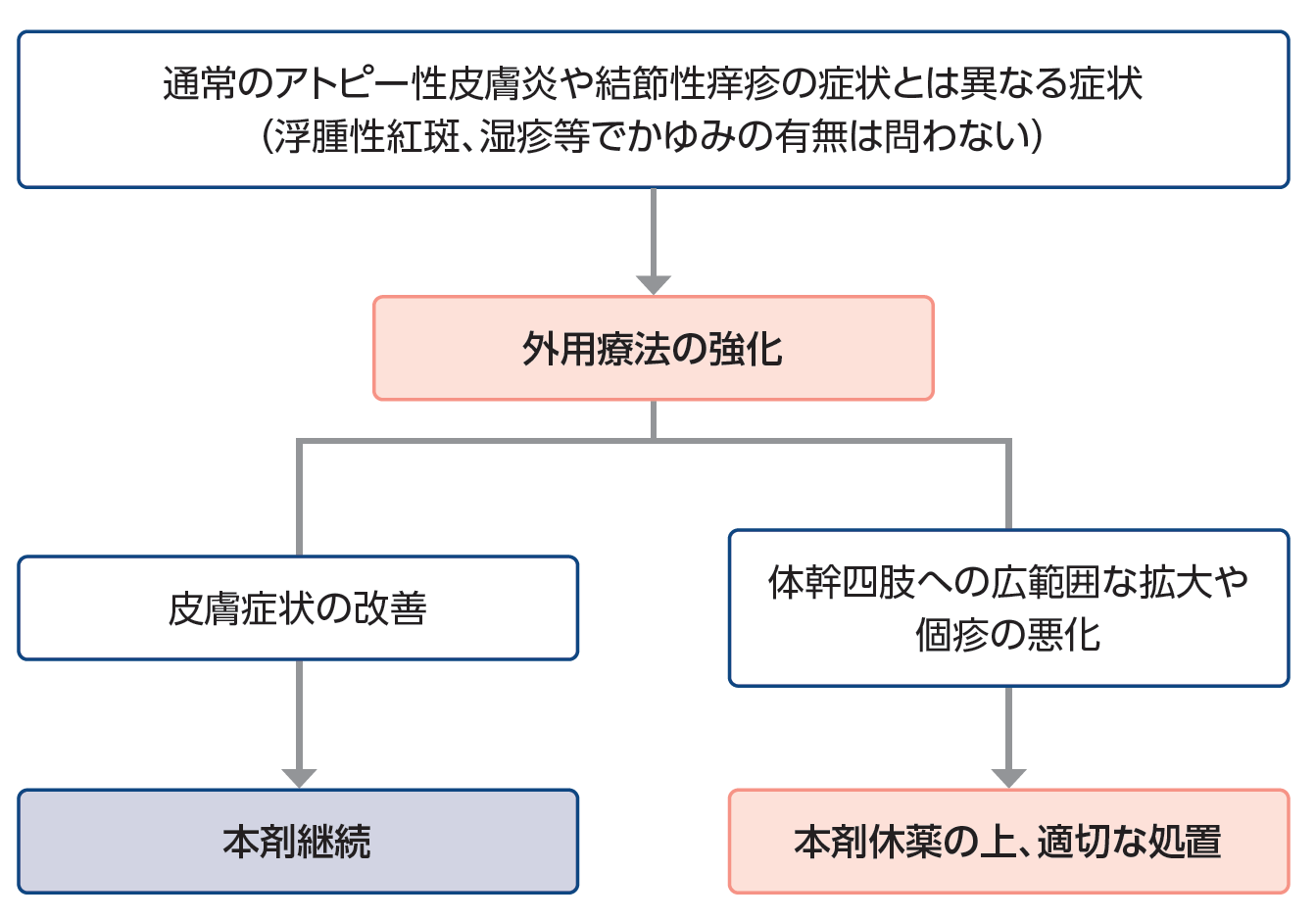
通常のアトピー性皮膚炎や結節性痒疹の症状とは異なる症状が発現した際の対応
ミチーガ投与後に、浮腫性紅斑、貨幣状湿疹などの、通常のアトピー性皮膚炎の症状とは異なる皮膚症状、又は結節性痒疹とは異なる症状が発現する可能性があります。
このような症状が認められた場合は、次のフローチャートをご参照いただき、適切な処置を行ってください4)。
電子添文の記載
- 7. 用法・用量に関連する注意
- 本剤投与後に浮腫性紅斑、湿疹等の発現を含む、皮膚症状の悪化が認められているので、皮膚症状が悪化した場合には、本剤の継続の可否について慎重に検討すること。



