maruho square:抗ヘルペスウイルス薬による脳症・腎症を防ぐ(前編)
-
- 日本腎臓病薬物療法学会監事・I&H株式会社学術研修部 平田 純生 先生
超高齢者大国の医療問題と帯状疱疹治療薬の問題点
わが国の高齢化率(65歳以上)は2021年時点で28.7%であり、2位のイタリアを5ポイント以上引き離し、類を見ない超高齢化社会を迎えており1)、2065年まで高齢化率38.4%で世界一であり続けることが予想されている。20歳以降、加齢に伴い1人当たりの国民医療費は増加し続けている。また、処方薬剤数の増加に伴い薬剤有害反応頻度が有意に上昇することが報告されており、これからのわが国の医療は高齢者の薬物療法がことさら重要となってくる。
水痘帯状疱疹ウイルス(VZV:varicella-zoster virus)の初感染は水痘(水疱瘡)になるが、水痘が治った後も神経節内にVZVが潜伏して、加齢やストレス、過労、悪性腫瘍の合併などで免疫能が低下すると、再活性化して何度も発症するのが帯状疱疹である。再活性化すると神経節内で増殖し、知覚神経を通って表皮に達し、ピリピリと刺すような痛みと、これに続いて皮膚に赤い斑点と小さな水疱が帯状に出現する。
腎排泄型の抗ヘルペスウイルス薬の腎症と脳症
1988年に発売開始されたアシクロビルは経口・静注製剤が発売されており、その治療効果が高いことから市場は拡大した。アシクロビルはプリン誘導体であるため、水溶性で腎排泄型であり、溶解度や吸収率が低い。筆者は透析専門病院に勤務していたため、治療薬物モニタリング対象薬ではないが、腎排泄型の抗ヘルペスウイルス薬やその代謝物の血中濃度をHPLCで測定し、当時の添付文書の腎機能別用量が甘いと考えていた2)。実際、腎機能低下患者の用量設定は徐々に厳しくなっていった。また、2020年5月に「中毒性脳症・高齢者への慎重投与について」という適正使用情報が出されている製品もあり、中毒性脳症にも注意が必要だ。
アシクロビルの薬物動態
アシクロビル錠は電子添付文書a)に「健康成人にアシクロビル200mg及び800mgを単回経口投与した場合、48時間以内にそれぞれ投与量の25.0%及び12.0%が未変化体として尿中に排泄された」と記載されている。この排泄率が25%という記載は、投与量を100%とした尿中の未変化体排泄率であり、単回経口投与時である。アシクロビル点滴静注用250mgの電子添付文書a)に「健康成人へ5又は10mg/kgを1時間点滴静注した時、48時間以内にそれぞれ68.6%又は76.0%が未変化体として尿中排泄された」とあり、用量が増えると経口剤とは逆に尿中未変化体排泄率が高くなる。これは尿細管の何らかのトランスポーターによって再吸収を受けるが、用量が多くなるとトランスポーターが飽和して、再吸収されなくなるため尿中未変化体排泄率が高くなると考えられる。このため尿中未変化体排泄率は静注製剤の68.6~76.0%と考えられ、腎機能に応じた減量が必須の腎排泄型薬物である。
アシクロビルは吸収過程にも排泄過程にも飽和があり、非線形の薬物動態をとる。つまり内服投与量が増えるほど何らかの消化管の吸収トランスポーターを介した吸収過程が飽和することから、少量頻回投与によって薬効を上げる戦略がとられ、帯状疱疹治療には「成人には1回アシクロビルとして800mgを1日5回経口投与する」となっている。
バラシクロビル
2000年に発売となったバラシクロビル塩酸塩はアシクロビルのL-バリルエステルであり、経口投与後、主に肝初回通過効果により活性体のアシクロビルに変換されて抗ウイルス作用を発現する。バラシクロビルのバイオアベイラビリティ(ほぼ吸収率と考えてよい)はペプチドトランスポーター(PEPT1)がバラシクロビルを栄養物のペプチドと誤認識するため、54.2%とアシクロビルよりも吸収が改善した。そのため帯状疱疹には「成人にはバラシクロビルとして1回1000mgを1日3回経口投与する」となり利便性が高まった。
アシクロビル静注500mgを1時間かけて静注投与すると吸収率を考慮する必要はないが、溶解する生理食塩液の量が少なく、かつ投与速度が速いと血中アシクロビル濃度上昇が予測される。バラシクロビル1000mg内服後の最高血漿中アシクロビル濃度は5.84±1.08μg/mLでアシクロビル800mg内服時の最高血漿中濃度0.94±0.23μg/mLに比べ高いa)。腎機能が正常であればGFRは100mL/minで1日約150Lの原尿が産生される。アシクロビルの蛋白結合率は低いため、血漿中濃度に近い濃度で原尿中にろ過され、尿細管でわずかにトランスポーターによって再吸収されるため、用量が少なければ68.6%、多ければ76.0%が排泄されると考えると理屈に合う。そして遠位尿細管では約100倍に濃縮されて1.5L/日の尿量を排泄すると、遠位尿細管以降では血中遊離型濃度の約100倍の濃度になる。アシクロビルの溶解度(37℃)はpH4.0で3.0mg/dL、pH6.8で2.6mg/dLであるためa)、バラシクロビル1000mg内服後の遠位尿細管以降の濃度は過飽和になり、容易に結晶が析出する状態と考えられる。
2010年に薬剤師が経験した高齢者の慢性腎臓病患者における調査では副作用経験薬剤のトップは腎排泄型の抗ヘルペスウイルス薬の1つである薬剤で41件であった3)。薬剤性腎障害の発現に関する同報告では、この薬剤の腎障害は5件のみで、この薬剤全158件の報告のうち3.16%であったことから、意識障害が主な副作用だと予測された3)。一方、一般的に薬剤性腎障害の報告薬効群では1位、2位が抗菌薬かNSAIDsが占めることが多いが、PMDAの医薬品副作用データベース(Japanese Adverse Drug Event Report database:JADER)を用いて12年間以上を集計した報告では薬剤性腎障害の発生件数12,964件中、発生件数上位10薬剤のうち、腎排泄型の抗ヘルペスウイルス薬効群を併せると1,024件であり、NSAIDs群を併せると535件であった4)。腎排泄型の抗ヘルペスウイルス薬効群はNSAIDs群の約2倍の発症頻度であり(表1)、腎排泄型の抗ヘルペスウイルス薬投与時には腎障害に注意が必要である。
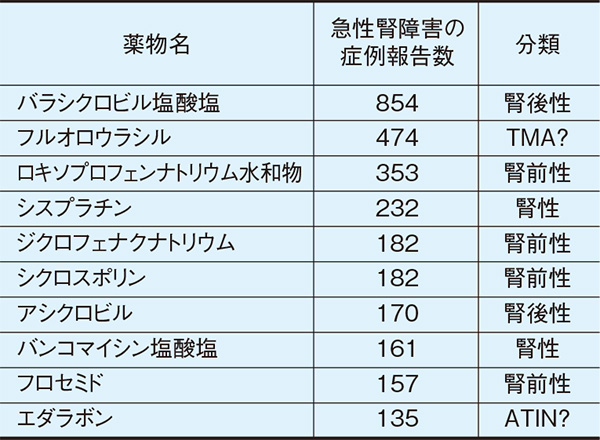
2004年4月~2017年1月までのJADERによる。
TMA:血栓性微小血管症(thrombotic microangiopathy)、ATIN:急性尿細管間質性腎炎(acute tubulointerstitial nephritis)
Hosohata K, et al: J Clin Pharm Ther 2019; 44: 49-53を改変
ファムシクロビル、アメナメビルの登場(表2)
2008年に発売されたファムシクロビルは、帯状疱疹には1日3回経口投与する。投与後は活性代謝物ペンシクロビルに変換される。ファムシクロビルのバイオアベイラビリティは77%と高く、活性代謝物ペンシクロビルの尿中排泄率は53~61%であるため、腎機能に応じた減量は従前の抗ヘルペスウイルス薬と同様に必要である。ペンシクロビルの水への溶解性(ファムシクロビル1gを溶かす水の量)は60mLa)であるためアシクロビルに比べ水への溶解度は高く、承認時迄の国内臨床試験(帯状疱疹)において、安全性評価対象例599例中、74例(12.4%)に副作用が認められたが腎障害の副作用は0件であったa)。またペンシクロビルは中枢移行が少ないため、中枢神経障害の副作用が起こりにくいと予測される。
2017年に発売されたアメナメビルは従来の抗ヘルペスウイルス薬と異なりLogP(1-オクタノール/水)が2.0と脂溶性の高い薬物で、14C標識アメナメビル200mg投与後、投与量の95.3%が回収され、大部分は糞便(74.6%)、次いで尿(20.6%)に排泄される。尿中未変化体排泄率は0.1%未満であったことから5)、腎機能に応じた減量が不要で、1日1回食後に経口投与する。承認時までの臨床試験において、317例中46例(14.5%)に副作用が認められたが中枢性および腎障害の副作用は0件であったa)他の腎排泄型抗ウイルス薬が尿酸と同様、プリン体骨格を持っているため溶解度が低いが、アメナメビルの溶解度が低いのは非核酸類似体構造で、おそらく脂溶性が高いことによると思われる。腎機能低下患者や筋肉量が減少して腎機能の判断が難しい高齢者には現時点ではアメナメビルは腎障害・意識障害の心配が少ない帯状疱疹治療薬といえよう。
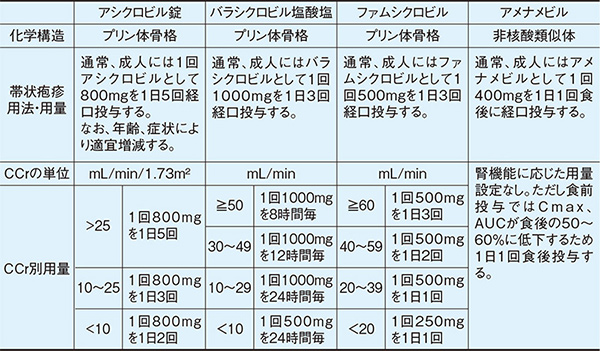
各社のインタビューフォーム・電子添付文書を基に作成
- 引用文献
-
- 世界の高齢化率(高齢者人口比率) 国別ランキング・推移 2022年7月29日更新)
(https://www.globalnote.jp/post-3770.html) - 古久保 拓, 他: 臨床薬理 2004; 35(1): 155S
- 和泉 智, 他: 日本病院薬剤師会雑誌 2010; 46(8): 989-992
- Hosohata K, et al.: J Clin Pharm Ther 2019; 44(1): 49-53
- Kato K, et al:. Clin Pharmacol Drug Dev 2019; 8(5): 595-602
- 各製品の電子添付文書、医薬品インタビューフォームを参照
- 世界の高齢化率(高齢者人口比率) 国別ランキング・推移 2022年7月29日更新)



