結節性痒疹患者(13歳以上)を対象とした第Ⅱ/Ⅲ相比較/長期継続投与試験
第Ⅱ/Ⅲ相比較/長期継続投与試験(M525101-11試験)
(1)試験概要
- 目的
-
主要な目的
- Part A:
- 既存治療を実施したにもかかわらず中等度以上のそう痒(かゆみスコア3以上かつPP-NRS7以上)を有する13歳以上の日本人の結節性痒疹患者を対象に、プラセボを対照としたランダム化、二重盲検、並行群間比較試験で、ミチーガ30mg(初回のみ60mg)又は60mgを4週ごとに投与した際の有効性を検証し、ミチーガの至適用量を検討する。有効性の主要評価項目は、投与開始16週後のPP-NRS(過去24時間の最大値のそう痒数値評価尺度)週平均の変化率とし、ミチーガのプラセボに対する優越性を検証する。
- Part B:
- Part Aを完了した患者を対象に、ミチーガ30mg又は60mgを4週ごとに長期投与(52週間)した際の安全性を、有害事象、臨床検査、バイタルサイン及び心電図で評価する。
副次的目的
- Part A:
- 既存治療を実施したにもかかわらず中等度以上のそう痒(かゆみスコア3以上かつPP-NRS7以上)を有する13歳以上の結節性痒疹患者を対象に、ミチーガ30mg(初回のみ60mg)又は60mgを4週ごとに投与した際の安全性を評価する。
- Part B:
- Part Aを完了した患者を対象に、ミチーガ30mg又は60mgを4週ごとに長期投与(52週間)した際の有効性を評価する。
- 対象
- 既存治療を実施したにもかかわらず中等度以上のそう痒(かゆみスコア3以上かつPP-NRS7以上)を有する13歳以上の結節性痒疹患者
- 選択基準
-
- 同意取得日の年齢が13歳以上で、登録日から6ヵ月以上前に結節性痒疹と臨床診断されており、少なくとも上肢又は下肢に結節性痒疹病変が認められ、全身で計20個以上の結節性痒疹が両側性に生じている患者
- 同意取得時点での外用治療:過去1年以内に結節性痒疹に対して、very strongクラス以上のステロイド外用剤を固定の用法で4週間以上使用したが、中等度以上のそう痒(かゆみスコア3以上)が残存していた患者、又はステロイド外用剤による治療を実施することができない患者(過敏症・禁忌等)
- 同意取得時点での抗ヒスタミン剤及び抗アレルギー剤による内服治療:過去に結節性痒疹に対して、抗ヒスタミン剤又は抗アレルギー剤を医師の指示通りに服用し2週間以上投与したが、中等度以上のそう痒(かゆみスコア3以上)が残存していた患者、又は抗ヒスタミン剤又は抗アレルギー剤で治療できない患者(過敏症・禁忌等)
- 登録日のかゆみスコア3以上かつPP-NRS7以上の患者
- ランダム化日を含む直前3日間のうち、2日がかゆみスコア3以上で残りの1日がかゆみスコア2以上、かつランダム化日を含む直前3日間のPP-NRSがすべて7以上の患者 等
- 除外基準
-
- 重篤な心・肝・腎・肺・血液疾患等、治験参加に不適当と考えられる疾患を合併している患者
- うっ血性心不全(ニューヨーク心臓協会[NYHA]心機能分類がⅢ以上)を合併している患者
- 悪性腫瘍を既往又は合併している患者
- 免疫機能が低下している患者
- 免疫グロブリン製剤に対する過敏症を既往又は合併している患者
- ステロイド剤、アミノフィリン点滴静注、0.1%アドレナリン皮下注、酸素吸入、抗体医薬品が必要なコントロール不良の喘息を合併している患者
- 中等症以上(アトピー性皮膚炎のstatic Investigator's Global Assessment[sIGA]が3以上を目安とする)と判断されたアトピー性皮膚炎患者、又は結節性痒疹のそう痒の評価に影響を及ぼすアトピー性皮膚炎のそう痒を有する患者
- ランダム化日の体重が30.0kg未満の患者
- ランダム化日前の120日以内に抗体医薬品による治療を行った患者
- ランダム化日前の28日以内に、全身投与医薬品[全身性のステロイド剤、免疫抑制剤、ナルフラフィン塩酸塩、マクロライド系抗菌薬、ニューロキニン-1(NK1)受容体拮抗薬、ガバペンチン、プレガバリン、ミロガバリン、抗うつ薬(選択的セロトニン再取込み阻害薬)、睡眠適応を有さないベンゾジアゼピン系抗不安薬の新規使用開始、用法・用量の変更、漢方薬(温清飲、越婢加朮湯、黄連解毒湯、柴苓湯、四物湯、大柴胡湯加減、補中益気湯、桂枝茯苓丸、桂枝加朮附湯)、レセルピン(2019年3月で国内販売中止)、ワクシニアウイルス接種家兎炎症皮膚抽出液含有製剤]、生ワクチン、結節性痒疹に対するすべての療法を実施した患者
- ランダム化日前の28~14日以内(登録日以降)に、そう痒治療を目的とした全身投与医薬品を使用した患者
- 登録以降ランダム化日まで、直前治療に規定された薬剤以外で、結節性痒疹及びアトピー性皮膚炎を治療した患者
- PN-IGAが2以下の患者
- PN-IGAが登録日から減少した患者
- ランダム化日を含む直前3日間の平均PP-NRSが、ランダム化日より7日前から9日前の3日間の平均PP-NRSと比較して3以上減少した患者
- 過去にミチーガ(プラセボ含む)を投与されたことがある患者 等
- 症例数
-
- Part A:
- 229例(ミチーガ30mg群77例、ミチーガ60mg群76例、プラセボ群76例)
- Part B:
- 218例(ミチーガ30mg群72例、ミチーガ60mg群73例、プラセボ/ミチーガ30mg群36例、プラセボ/ミチーガ60mg群37例)
- 投与方法a)
-
Part A(治療期間:16週間):
ランダム化日、4、8及び12週後来院時に、治験薬を上腕部、腹部又は大腿部のうち、病変のない皮膚を選択し、皮下投与した。盲検性を維持するため、ミチーガ30mg群はミチーガ30mgバイアル1本とプラセボバイアル1本(初回投与はミチーガ30mgバイアル2本)、ミチーガ60mg群はミチーガ30mgバイアル2本、プラセボ群はプラセボバイアル2本を治験薬として投与した。Part B(治療期間:52週間):
16週後来院時以降、64週後来院時まで4週ごとに、治験薬を上腕部、腹部又は大腿部のうち、病変のない皮膚を選択し、皮下投与した。盲検性を確保するため、ミチーガ30mg群及びプラセボ/ミチーガ30mg群は、ミチーガ30mgバイアル1本とプラセボバイアル1本(プラセボ/ミチーガ30mg群の初回投与はミチーガ30mgバイアル2本)、ミチーガ60mg群及びプラセボ/ミチーガ60mg群は、ミチーガ30mgバイアル2本を治験薬として投与した。 - 評価項目
-
<有効性>
- 主要評価項目(Part A)
- 投与開始16週後のPP-NRS週平均の変化率(検証的な解析項目)
- 副次評価項目(Part A)
- 投与開始2週後までの各日のPP-NRS変化率の経時推移
- 投与開始16週後のPP-NRS週平均が4以上改善した患者の割合
- 投与開始16週後のかゆみスコア週平均が1以下になった患者の割合
- 投与開始16週後のPN-IGAスコアが2段階以上改善かつ1以下になった患者の割合
- 投与開始16週後の結節性痒疹数変化率(代表的部位b)、頭頚部を除く全身)
- 投与開始16週後のISI合計スコアが7以下になった患者の割合
- 投与開始16週後のDLQIc)合計スコアが4以下になった患者の割合
- 投与開始16週後の睡眠障害NRS週平均の変化率
- 投与開始2週後までの各日の睡眠障害NRS変化率の経時推移
- その他の評価項目
-
- 経時推移:
- PP-NRS、かゆみスコア、PN-IGA、結節性痒疹数(代表的部位b)、頭頚部を除く全身、上肢、下肢、体幹)、ISI、DLQIc)、睡眠障害NRS、WPAI-GH(Q7~Q10) 等
-
- 改善割合:
- PP-NRS週平均が4以上改善した患者の割合、PP-NRS-50達成率、PP-NRS-75達成率、PP-NRS-90達成率、かゆみスコアが1以下になった患者の割合、PN-IGAスコアが2段階以上改善かつ1以下になった患者の割合、ISI合計スコアが7以下になった患者の割合、DLQIc)合計スコアが4以上改善した患者の割合、睡眠障害NRS-50達成率、睡眠障害NRS-75達成率、睡眠障害NRS-90達成率、睡眠障害NRSが4以上改善した患者の割合 等
- ステロイド外用剤の使用量 等
<安全性>
有害事象、臨床検査、バイタルサイン、心電図、免疫原性(血清中抗ネモリズマブ抗体)
<薬物動態>
血清中ネモリズマブ濃度
- 解析計画
-
- 解析計画
-
<有効性>
- 主要評価項目(Part A)
投与開始16週後のPP-NRS週平均の変化率は、Full analysis set(FAS)を対象に、混合効果モデル(MMRM)を用いて、投与群及び時点ごとにPP-NRS週平均の変化率の最小二乗平均値、標準誤差(SE)、両側95%信頼区間(CI)を算出した。また、ミチーガ30mg群又はミチーガ60mg群とプラセボ群の差の最小二乗平均値、SE、両側95%CI及びp値を算出した。主要評価項目の解析では、全体の第一種の過誤を5%以下とするため、Hochberg法により検定の多重性を調整した。ミチーガの用量間の検定は行わなかった。
[検定手順]
ミチーガ30mg群 vs. プラセボ群及びミチーガ60mg群 vs. プラセボ群のp値の大きい方が有意水準両側5%を下回った場合、両群でプラセボに対する優越性が検証されたと判断し、検定を終了し、有意水準両側5%を上回った場合は、ミチーガ30mg群 vs. プラセボ群及びミチーガ60mg群 vs. プラセボ群のp値の小さい方が有意水準両側2.5%を下回った場合に、当該ミチーガ投与群のプラセボに対する優越性が検証されたと判断した。さらに、MMRMを用いて、応答変数を生値、変化量にそれぞれ変更したもとで、投与群、時点ごとの最小二乗平均値、SE、両側95%CIを算出した。応答変数が生値の場合、ベースラインのPP-NRS週平均は共変量には含めず、応答変数ベクトルに含めた。結節性痒疹又はアトピー性皮膚炎の悪化のために行ったレスキュー治療後のデータは欠測とした。主要評価項目の主解析では、観測した経時データをMMRMで解析するため、欠測データは補完しなかった。主要評価項目の感度分析のうち、Last observation carried forward(LOCF)による補完法では、投与開始16週後のPP-NRS週平均が欠測している場合、LOCFにより、投与開始16週後のデータを直前の観測時点のデータで補完した。また、Tipping point analysis法では、補完モデルとして、ベースラインのPP-NRS週平均及びアトピー性皮膚炎の合併の有無、治験薬投与開始1、2、4、8、12及び16週後のPP-NRS週平均の変化率を用いて、各時点の欠測しているPP-NRS週平均の変化率を多重補完法により補完した(補完回数:50回)。
- 副次評価項目(Part A)
副次評価項目については、複数評価項目間及び複数時点間の多重性は調整せず、一律に有意水準は両側5%とした。投与開始2週後までの各日のPP-NRS変化率、投与開始16週後の睡眠障害NRS週平均の変化率、投与開始2週後までの各日の睡眠障害NRS変化率、投与開始16週後の結節性痒疹数変化率(代表的部位b)、頭頚部を除く全身)については、MMRMを用いて投与群、時点ごとの最小二乗平均値、SE、両側95%CIを算出し、さらに、群間差の最小二乗平均値、SE、両側95%CI及びp値も算出した。各評価指標の変化率を応答変数とし、睡眠障害NRSはベースラインの睡眠障害NRS週平均及びアトピー性皮膚炎の合併の有無を、結節性痒疹数(代表的部位b))は部位(上肢、下肢、体幹)を、結節性痒疹数(頭頚部を除く全身)はベースラインの全身(頭頚部を除く)の結節性痒疹数(50個未満、50個以上100個未満、100個以上200個未満、200個以上)をそれぞれ共変量に用いた。投与開始16週後のPP-NRS週平均が4以上改善した患者の割合、投与開始16週後のかゆみスコア週平均が1以下になった患者の割合、投与開始16週後のPN-IGAスコアが2段階以上改善かつ1以下になった患者の割合、投与開始16週後のISI合計スコアが7以下になった患者の割合(同意取得時の年齢が15歳以上かつベースラインのISI合計スコアが8以上の患者を対象)は、各評価指標の例数及び割合を投与群、時点ごとに求め、さらに割合の群間差とその両側95%CI、Fisherの正確検定による両側p値を算出した。連続データの解析では、主要評価項目と同様にMMRMにより解析するため、欠測は補完しなかった。二値データの解析では、欠測はノンレスポンダーを補完した。
- その他の評価項目
PP-NRS、かゆみスコア及び睡眠障害NRSに関しては、特に記載のない限りレスキュー治療後のデータは欠測として取り扱い、それ以外の有効性データは特に記載のない限りレスキュー治療後のデータも集計に含めた。
- 経時推移:FAS(Part A)及び長期投与期間FAS(Part A/B)を対象に、連続変数[PP-NRS、睡眠障害NRS、結節性痒疹数(代表的部位b)、頭頚部を除く全身、上肢、下肢、体幹)、かゆみスコア、ISI(合計及び項目別スコア)、DLQIc)(合計及び項目別スコア)、WPAI-GH(Q7~Q10)]は要約統計量を、離散変数[かゆみスコア、PN-IGA]は例数及び割合を投与群及び時点ごとに求めた。
- 改善割合:FAS(Part A)及び長期投与期間FAS(Part A/B)を対象に、以下の基準まで改善した患者の割合を投与群及び時点ごとに求めた。さらにPart Aの集計では、割合の群間差とその両側95%CI、Fisherの正確検定による両側p値を算出した。
- PP-NRS:ベースラインから50%以上改善・75%以上改善・90%以上改善(それぞれPP-NRS-50達成率・PP-NRS-75達成率・PP-NRS-90達成率)、ベースラインから4以上改善(「4以上改善」の集計はPart A/B期間のみ)
- かゆみスコア:1以下(Part A/B期間のみ)
- PN-IGA:ベースラインからスコア2段階以上改善かつ1以下(Part A/B期間のみ)
- ISI:合計スコア7以下(Part A/B期間のみ)
- DLQIc):ベースラインから合計スコア4以上改善
- 睡眠障害NRS:ベースラインから50%以上改善・75%以上改善・90%以上改善(それぞれ睡眠障害NRS-50達成率・睡眠障害NRS-75達成率・睡眠障害NRS-90達成率)、ベースラインから4以上改善 等
- ステロイド外用剤の使用量:FAS(Part A)及び長期投与期間FAS(Part A/B)を対象に、各来院日間の1日当たりのステロイド外用剤の使用量の要約統計量を算出した。
<安全性>
Part Aでは安全性解析対象集団(SAF)、Part A/Bでは長期投与期間SAFを解析対象とした。Part A/Bの集計にはフォローアップ期間に発現した有害事象も含めた。有害事象はMedDRA/J Version 23.1を用いて読み替えた。重要な有害事象は、治験薬の投与中止に至った有害事象(休薬・減量を含む)及び注目すべき有害事象とした。注目すべき有害事象は、a)注射関連の反応※(注射部位の局所反応及び全身性の注射反応を含む)、b)喘息、c)アトピー性皮膚炎(悪化又は再燃を含む)、d)浮腫性紅斑又は鱗屑を伴う皮膚症状、e)皮膚感染症、f)皮膚以外の感染症、g)治験薬からの感染病原体感染の疑い、と定義した。血清TARC値と結節性痒疹数及びPP-NRSの相関性については、投与開始8、16週後の血清TARC値の変化率と結節性痒疹数の変化率(頭頚部を除く全身)及びPP-NRS変化率の散布図を投与群別に作成し、Pearson及びSpearmanの相関係数を算出した。
免疫原性:薬物動態解析対象集団を対象に、血清中抗ネモリズマブ抗体の試験結果を、試験(screening、confirmatory、neutralizing)、投与群及び時点ごとに集計した。また、抗ネモリズマブ抗体陽性の患者の割合を投与群別に求めた。ミチーガ30mg群及びミチーガ60mg群は、治験薬投与後に初めて陽性となった患者又は投与前後がいずれも陽性となった患者のうち、抗体価の差が4倍以上であった患者と定義し、プラセボ/ミチーガ30mg群及びプラセボ/ミチーガ60mg群はいずれかの時点でconfirmatory試験の結果が陽性と判定された患者と定義した。- ※
- 注射関連の反応は、治験薬投与後24時間以内に発現した有害事象と定義した。
<薬物動態>
薬物動態解析対象集団を対象に、投与群及び時点ごとに血清中ネモリズマブ濃度の要約統計量を求めた。また、ランダム化日の体重別に、同様に集計した。
- a)
- 本試験におけるミチーガの用量のうち、ミチーガ60mgの4週ごとの投与は、結節性痒疹患者を対象とした海外第Ⅱa相試験(SPR.115828試験)及び18歳以上65歳以下のアトピー性皮膚炎患者を対象に国内と海外で実施した第Ⅱ相試験(CIM003JG試験)での有効性及び安全性の結果に、成人及び13歳以上の小児のアトピー性皮膚炎患者を対象とした国内第Ⅲ相試験(M525101-01試験及びM525101-02試験)から考えられた本試験の結節性痒疹患者の体重(最大120kg程度)を考慮して設定した。ミチーガ30mgの4週ごとの投与は、ミチーガ60mgの4週ごとの投与より低用量での有効性を確認するため、SPR.115828試験及びCIM003JG試験の結果に基づき、60kgの患者でミチーガ0.5mg/kgの4週ごとの投与に相当する用量として設定した。また、血清中ネモリズマブ濃度を定常状態に到達させ、投与開始早期にそう痒を改善させるため、初回投与量を60mgと設定した。
- b)
- 治験責任(分担)医師は、登録日に代表的な結節性痒疹の症状を呈する部位を代表的部位として1ヵ所特定することとした。
- c)
- 同意取得日の年齢が16歳未満の患者は、治験期間を通じてCDLQIを用いて評価した。
(2)試験デザイン
- a)
- Part Aでミチーガ30mg群の患者は、初回のみミチーガ60mgを投与した。また、Part Aではプラセボ群で、Part Bではミチーガ30mg群に割り当てられた患者は、初回のみミチーガ60mgを投与した。
- b)
- ランダム化以降、用法を減ずること(連日併用から隔日併用への変更、1日の投与回数の減少、休薬、中止等)、用法を減じた場合は登録日に固定した用法に戻すこと、及び薬剤を休薬又は中止後に同じ薬剤の使用を再開することは可とした。
(3)患者背景
⼈⼝統計学的及び他の基準値の特性(FAS)
| プラセボ群 (n=76) |
ミチーガ30mg群 (n=77) |
ミチーガ60mg群 (n=76) |
|
|---|---|---|---|
| 性別:男性、例数(%) 女性、例数(%) |
36(47.4) 40(52.6) |
37(48.1) 40(51.9) |
34(44.7) 42(55.3) |
| 年齢中央値、歳(範囲) | 54.0(15-78) | 50.0(15-84) | 51.0(13-75) |
| 結節性痒疹罹病期間中央値、年(範囲) | 4.76(0.6-40.3) | 3.33(0.6-21.1) | 3.76(0.5-61.5) |
| アトピー性皮膚炎の併発あり、例数(%) | 10(13.2) | 12(15.6) | 10(13.2) |
| アレルギー疾患の罹患歴又は併発あり、例数(%) | 46(60.5) | 47(61.0) | 47(61.8) |
| Strongクラスステロイド外用剤ありa) | |||
| アトピー性皮膚炎に対して、例数(%) | 8(10.5) | 10(13.0) | 9(11.8) |
| 結節性痒疹に対して、例数(%) | 76(100) | 77(100) | 76(100) |
| 代表的部位の病変あり | |||
| 上肢、例数(%) | 25(32.9) | 34(44.2) | 23(30.3) |
| 下肢、例数(%) | 41(53.9) | 30(39.0) | 32(42.1) |
| 体幹、例数(%) | 10(13.2) | 13(16.9) | 21(27.6) |
| 結節性痒疹数:代表的部位b) | |||
| 中央値(範囲) | 33.0(10-207) | 39.0(8-580) | 31.0(4-229) |
| 19個以下、例数(%) | 16(21.1) | 16(20.8) | 20(26.3) |
| 20~49個、例数(%) | 35(46.1) | 30(39.0) | 26(34.2) |
| 50~99個、例数(%) | 20(26.3) | 21(27.3) | 21(27.6) |
| 100個以上、例数(%) | 5(6.6) | 10(13.0) | 9(11.8) |
| 結節性痒疹数:頭頚部を除く全身 | |||
| 中央値(範囲) | 94.0(21-637) | 151.0(21-2613) | 118.5(13-596) |
| 50個未満、例数(%) | 12(15.8) | 11(14.3) | 16(21.1) |
| 50個以上100個未満、例数(%) | 27(35.5) | 16(20.8) | 19(25.0) |
| 100個以上200個未満、例数(%) | 22(28.9) | 24(31.2) | 19(25.0) |
| 200個以上、例数(%) | 15(19.7) | 26(33.8) | 22(28.9) |
| PP-NRS中央値(範囲) | 8.36(7.0-10.0) | 8.57(6.4-10.0) | 8.38(6.7-10.0) |
| かゆみスコア中央値(範囲) | 3.00(2.6-4.0) | 3.00(2.7-4.0) | 3.00(2.4-4.0) |
| PN-IGAスコア:3、例数(%) 4、例数(%) |
41(53.9) 35(46.1) |
35(45.5) 42(54.5) |
36(47.4) 40(52.6) |
| DLQIc)スコア中央値(範囲) | 11.0(3-27) | 12.0(3-26) | 12.0(3-21) |
| 睡眠障害NRSスコア中央値(範囲) | 8.00(0.0-10.0) | 7.86(0.0-10.0) | 7.57(0.0-10.0) |
| 血清TARC値中央値、ng/L(範囲) | 610.5(124-57900) | 645.0(141-20500) | 470.0(125-18200) |
- a)
- ランダム化日前の14日間で最も高いクラスのステロイド外用剤
- b)
- 治験責任(分担)医師は、登録日に代表的な結節性痒疹の症状を呈する部位を代表的部位として1ヵ所特定することとした。
- c)
- 同意取得日の年齢が16歳未満の患者は、治験期間を通じてCDLQIを用いて評価した。
有効性 Part A(投与開始~16週)
かゆみ評価(PP-NRS、かゆみスコア)
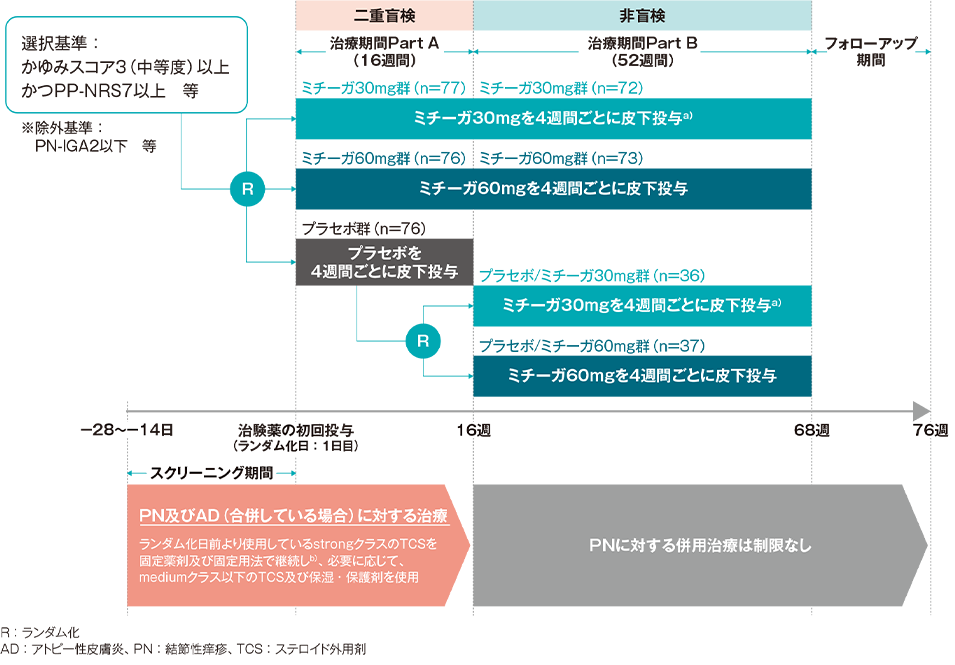
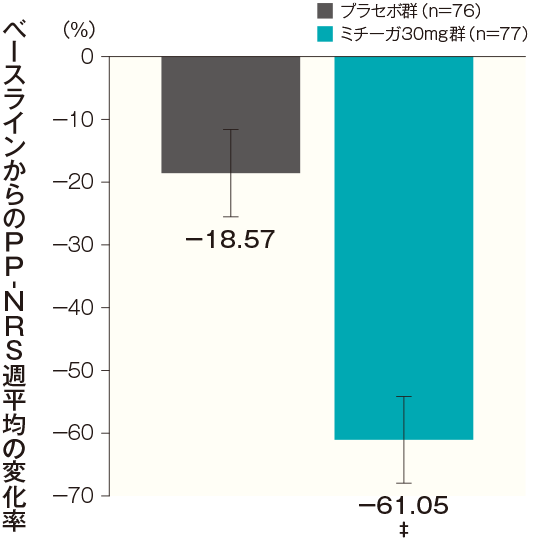
投与開始16週後のPP-NRS週平均の変化率(主要評価項目:検証的解析結果)
投与開始16週後のベースラインからのPP-NRS週平均の変化率(最小二乗平均値)は、プラセボ群では−18.57%、ミチーガ30mg群では−61.05%であった。両群間の差(ミチーガ30mg群-プラセボ群、最小二乗平均値)は−42.48%(95%CI:−51.91~−33.05%)であり、統計学的に有意な差が認められ(p<0.0001[調整後]、MMRM※)、プラセボ群に対するミチーガ30mg群の優越性が検証された。
最小二乗平均値±両側95%CI
**:p<0.0001、‡:p<0.0001(調整後)、MMRM※(vs.プラセボ群)、投与開始16週後以外は名目上のp値
- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインのPP-NRS週平均とアトピー性皮膚炎の合併の有無を共変量とした。投与開始16週後は、MMRMで解析後、Hochberg法により多重性を考慮した調整済みp値を算出した。
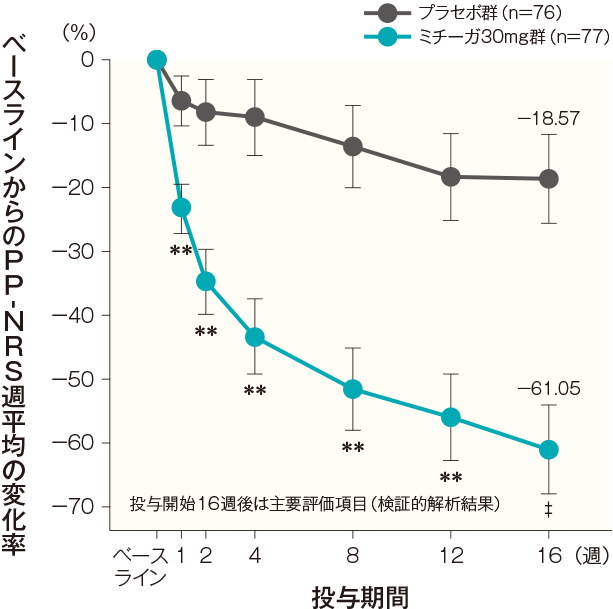
- 投与開始2週後までの各日のPP-NRS変化率の経時推移(FAS)(副次評価項目)
-
初回投与翌日(投与開始2日後)のベースラインからのPP-NRS変化率(最小二乗平均値)は、プラセボ群では-4.22%、ミチーガ30mg群では-9.26%であった。両群間の差(ミチーガ30mg群−プラセボ群、最小二乗平均値)は−5.04%(95%CI:−8.39~−1.69%)であり、統計学的に有意な差が認められ、その効果は投与開始15日後まで継続して認められた(投与開始2日後:p<0.01、投与開始3日後~15日後の各時点:p<0.0001、MMRM※、名目上のp値)。
投与開始2週後までの各日のPP-NRS変化率の経時推移(FAS) 記事/インライン画像 PP-NRSの詳細はこちら
PP-NRSの詳細はこちら- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインのPP-NRSとアトピー性皮膚炎の合併の有無を共変量とした。
- 投与開始16週後のPP-NRS週平均が4以上改善した患者の割合(FAS)(副次評価項目)
-
投与開始16週後のPP-NRS週平均がベースラインから4以上改善した患者の割合は、プラセボ群では11.8%、ミチーガ30mg群では62.3%であった。両群間の差(ミチーガ30mg群−プラセボ群)は50.5%(95%CI:37.5~63.5%)であり、統計学的に有意な差が認められた(p<0.0001、Fisherの正確検定、名目上のp値)。
投与開始16週後のPP-NRS週平均がベースラインから4以上改善した患者の割合(FAS) 記事/インライン画像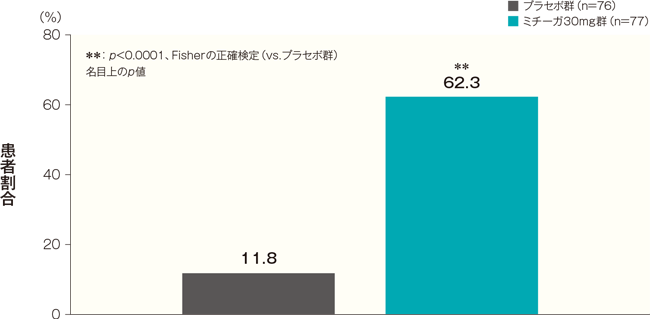 PP-NRSの詳細はこちら
PP-NRSの詳細はこちらベースラインのPP-NRS週平均が4以上の患者について解析した。
- 投与開始16週後のPP-NRS-50達成率、PP-NRS-75達成率、PP-NRS-90達成率(FAS)(その他の評価項目)
-
[PP-NRS-50達成率]
投与開始16週後のPP-NRS-50達成率は、プラセボ群では11.8%、ミチーガ30mg群では61.0%であった。両群間の差(ミチーガ30mg群−プラセボ群)は49.2%(95%CI:36.1~62.3%)であり、統計学的に有意な差が認められた(p<0.0001、Fisherの正確検定、名目上のp値)。
[PP-NRS-75達成率]
投与開始16週後のPP-NRS-75達成率は、プラセボ群では2.6%、ミチーガ30mg群では31.2%であった。両群間の差(ミチーガ30mg群−プラセボ群)は28.5%(95%CI:17.6~39.5%)であり、統計学的に有意な差が認められた(p<0.0001、Fisherの正確検定、名目上のp値)
[PP-NRS-90達成率]
投与開始16週後のPP-NRS-90達成率は、プラセボ群では1.3%、ミチーガ30mg群では13.0%であった。両群間の差(ミチーガ30mg群−プラセボ群)は11.7%(95%CI:3.7~19.6%)であり、統計学的に有意な差が認められた(p<0.01、Fisherの正確検定、名目上のp値)。
なお、ミチーガ30mg群は、PP-NRS-50達成率が投与開始1週後、PP-NRS-75達成率が投与開始2週後、PP-NRS-90達成率が投与開始4週後にプラセボ群と比較して有意に高値となった(それぞれp<0.01、p<0.05、p<0.05、Fisherの正確検定、名目上のp値)。
PP-NRSの詳細はこちら記事/インライン画像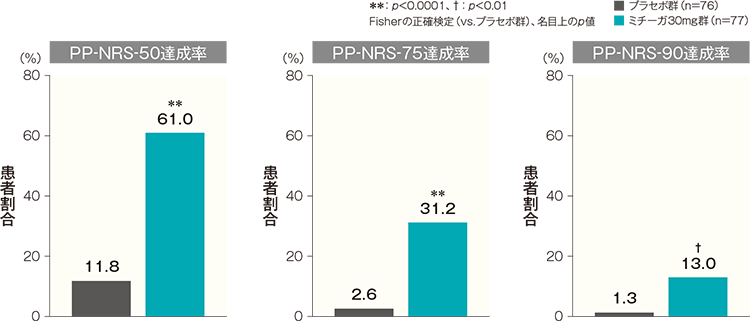
- 投与開始16週後のかゆみスコア週平均が1以下になった患者の割合(FAS)(副次評価項目)
-
投与開始16週後のかゆみスコア週平均が1以下になった患者の割合は、プラセボ群では2.6%、ミチーガ30mg群では32.5%であった。両群間の差(ミチーガ30mg群−プラセボ群)は29.8%(95%CI:18.8~40.9%)であり、統計学的に有意な差が認められた(p<0.0001、Fisherの正確検定、名目上のp値)。
かゆみスコアの詳細はこちら投与開始16週後のかゆみスコア週平均が1以下になった患者の割合(FAS) 記事/インライン画像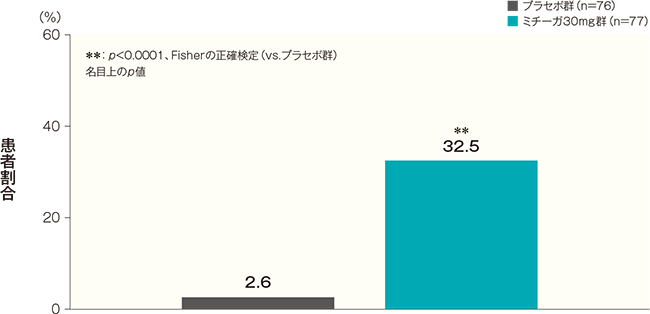
皮膚症状の評価(PN-IGA、結節性痒疹数)
投与開始16週後のPN-IGAスコアが2段階以上改善かつ1以下になった患者の割合(FAS)(副次評価項目)
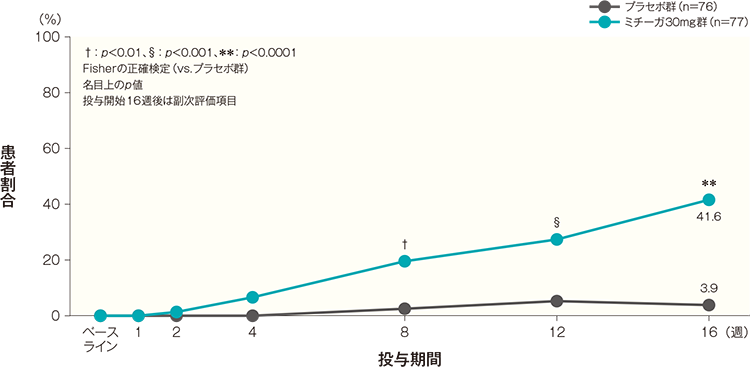
投与開始16週後のPN-IGAスコアがベースラインから2段階以上改善かつ1以下になった患者の割合は、プラセボ群では3.9%、ミチーガ30mg群では41.6%であった。両群間の差(ミチーガ30mg群−プラセボ群)は37.6%(95%CI:25.8~49.5%)であり、統計学的に有意な差が認められた(p<0.0001、Fisherの正確検定、名目上のp値)。
患者の割合の経時推移(FAS)(その他の評価項目)
投与開始16週後の結節性痒疹数変化率(代表的部位)(FAS)(副次評価項目)
投与開始16週後のベースラインからの代表的部位の結節性痒疹数変化率(最小二乗平均値)は、プラセボ群では-5.91%、ミチーガ30mg群では-65.83%であり、ミチーガ30mg群は、プラセボ群と比較して、代表的部位の結節性痒疹数を有意に減少した(p<0.0001、MMRM※1、名目上のp値)。
(代表的部位)(FAS)(その他の評価項目)
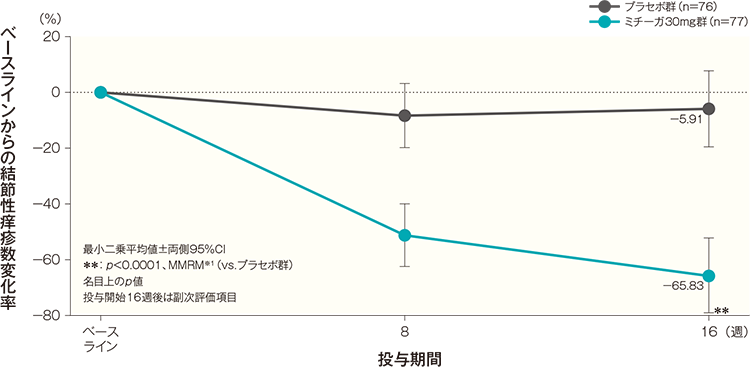
- ※1:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインの代表的部位(上肢、下肢、又は体幹)の結節性痒疹数を共変量とした。
- 投与開始16週後の結節性痒疹数変化率(頭頚部を除く全身)(副次評価項目)
-
投与開始16週後のベースラインからの頭頚部を除く全身の結節性痒疹数変化率(最小二乗平均値)は、プラセボ群では-6.00%、ミチーガ30mg群では-68.27%であり、ミチーガ30mg群は、プラセボ群と比較して、頭頚部を除く全身の結節性痒疹数を有意に減少した(p<0.0001、MMRM※2、名目上のp値)。
ベースラインから投与開始16週後までの結節性痒疹数変化率の経時推移
(頭頚部を除く全身)(FAS)(その他の評価項目)記事/インライン画像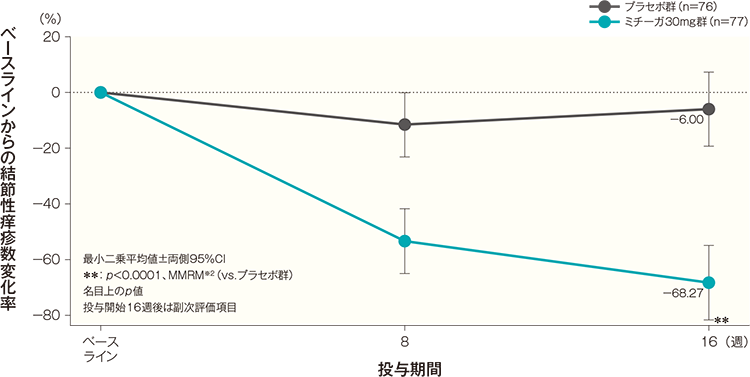
- ※2:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインの頭頚部を除く全身の結節性痒疹数(50個未満、50個以上100個未満、100個以上200個未満、200個以上)を共変量とした。
QOL評価(ISI、DLQI、睡眠障害NRS)
投与開始16週後のISI合計スコアが7以下になった患者の割合(FAS)(副次評価項目)
投与開始16週後のISI合計スコアが7以下になった患者の割合は、プラセボ群では17.9%、ミチーガ30mg群では44.3%であった。両群間の差(ミチーガ30mg群−プラセボ群)は26.4%(95%CI:10.9~41.8%)であり、統計学的に有意な差が認められた(p<0.01、Fisherの正確検定、名目上のp値)。
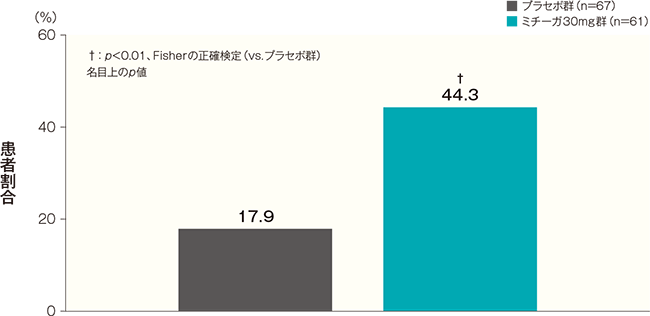
同意取得時の年齢が15歳以上かつベースラインのISI合計スコアが8以上の患者について解析した。
- 投与開始16週後のDLQI合計スコアが4以下になった患者の割合(FAS)(副次評価項目)
-
投与開始16週後のDLQI合計スコアが4以下になった患者の割合は、プラセボ群では24.3%、ミチーガ30mg群では57.7%であった。両群間の差(ミチーガ30mg群−プラセボ群)は33.5%(95%CI:18.2~48.7%)であり、統計学的に有意な差が認められた(p<0.0001、Fisherの正確検定、名目上のp値)。
投与開始16週後のDLQI合計スコアが4以下になった患者の割合(FAS) 記事/インライン画像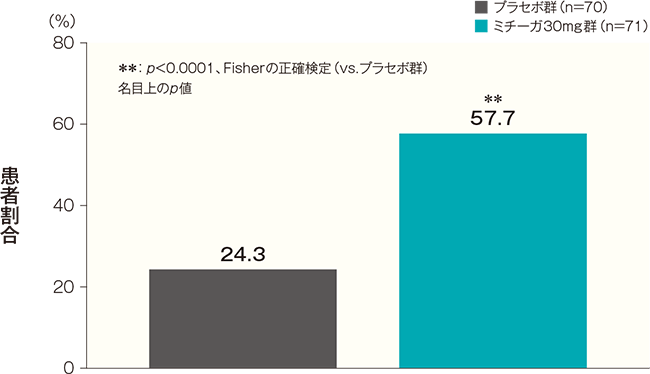 DLQIの詳細はこちら
DLQIの詳細はこちら同意取得時の年齢が16歳以上かつベースラインのDLQI合計スコアが5以上の患者について解析した。
同意取得日の年齢が16歳未満の患者は、治験期間を通じてCDLQIを用いて評価した。
- DLQI合計スコアが4以上改善した患者の割合(FAS)(その他の評価項目)
-
DLQI合計スコアがベースラインから4以上改善した患者の割合は、プラセボ群では投与開始1週後が33.3%、2週後が41.7%、4週後が38.9%、8週後が40.3%、16週後が43.1%、ミチーガ30mg群ではそれぞれ61.1%、66.7%、73.6%、73.6%、77.8%であり、すべての時点でミチーガ30mg群が有意に高かった(投与開始1週後及び2週後:p<0.01、投与開始4週後、8週後、16週後:p<0.0001、Fisherの正確検定、名目上のp値)。
DLQI合計スコアが4以上改善した患者の割合(FAS) 記事/インライン画像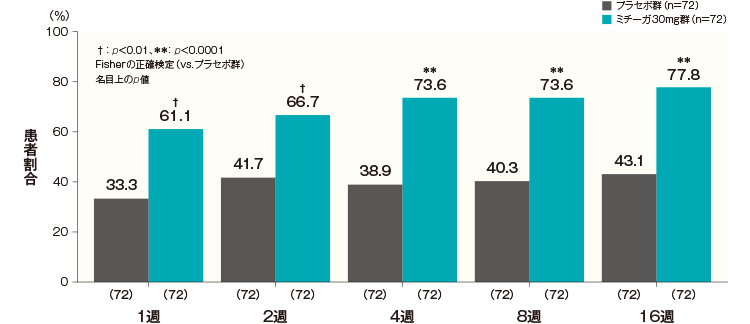 DLQIの詳細はこちら
DLQIの詳細はこちらベースラインのDLQI合計スコアが4以上の患者について解析した。
同意取得日の年齢が16歳未満の患者は、治験期間を通じてCDLQIを用いて評価した。
横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
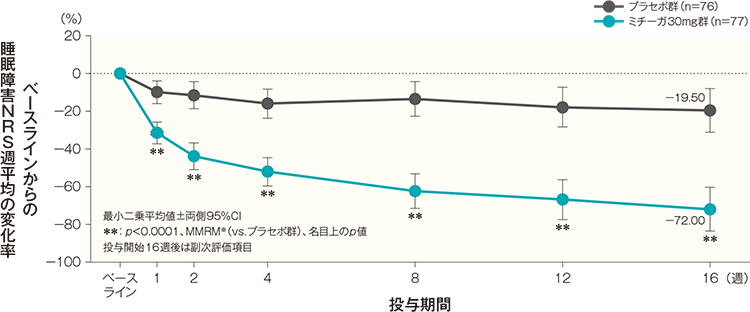
投与開始16週後の睡眠障害NRS週平均の変化率(FAS)(副次評価項目)
投与開始16週後のベースラインからの睡眠障害NRS週平均の変化率(最小二乗平均値)は、プラセボ群では-19.50%、ミチーガ30mg群では-72.00%であった。両群間の差(ミチーガ30mg群-プラセボ群、最小二乗平均値)は-52.50%(95%CI:-68.39~-36.61%)であり、統計学的に有意な差が認められた(p<0.0001、MMRM※、名目上のp値)。
- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインの睡眠障害NRS週平均とアトピー性皮膚炎の合併の有無を共変量とした。
- 投与開始2週後までの各日の睡眠障害NRS変化率の経時推移(FAS)(副次評価項目)
-
初回投与翌日(投与開始2日後)のベースラインからの睡眠障害NRS変化率(最小二乗平均値)は、プラセボ群では-1.26%、ミチーガ30mg群では-16.88%であった。両群間の差(ミチーガ30mg群−プラセボ群、最小二乗平均値)は−15.62%(95%CI:−26.61~−4.64%)であり、統計学的に有意な差が認められ、その効果は投与開始15日後まで継続して認められた(投与開始2日後:p<0.01、投与開始3日後~15日後の各時点[15日目]:p<0.0001、MMRM※、名目上のp値)。
投与開始2週後までの各日の睡眠障害NRS変化率の経時推移(FAS) 記事/インライン画像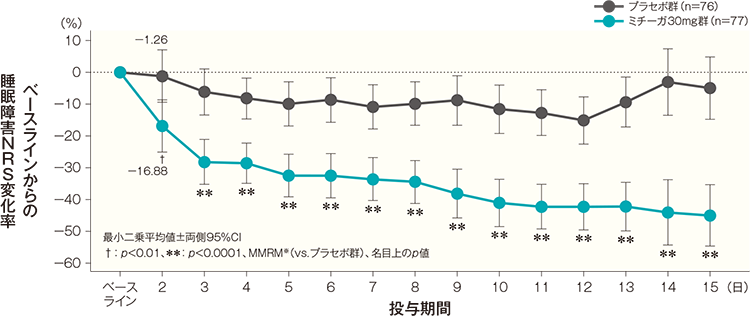 睡眠障害NRSの詳細はこちら
睡眠障害NRSの詳細はこちら- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインの睡眠障害NRSとアトピー性皮膚炎の合併の有無を共変量とした。
- 投与開始16週後の睡眠障害NRSが4以上改善した患者の割合(FAS)(その他の評価項目)
-
投与開始16週後の睡眠障害NRSがベースラインから4以上改善した患者の割合は、プラセボ群では21.2%、ミチーガ30mg群では64.1%であった。両群間の差(ミチーガ30mg群−プラセボ群)は42.9%(95%CI:27.5~58.2%)であり、統計学的に有意な差が認められた(p<0.0001、Fisherの正確検定、名目上のp値)。
投与開始16週後の睡眠障害NRSが4以上改善した患者の割合(FAS) 記事/インライン画像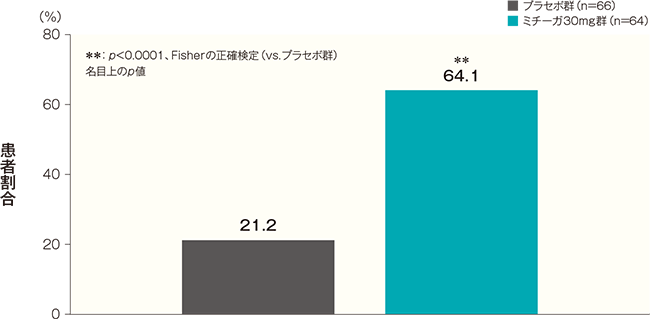 睡眠障害NRSの詳細はこちら
睡眠障害NRSの詳細はこちらベースラインの睡眠障害NRS週平均が4以上の患者について解析した。
安全性 Part A期間
- 副作用発現状況
-
副作用は、プラセボ群では76例中9例(11.8%)に11件、ミチーガ30mg群では77例中23例(29.9%)に34件、ミチーガ60mg群では76例中16例(21.1%)に33件認められた。
本試験において、死亡に至った副作用及び重篤な副作用は認められなかった。
治療の調整に至った副作用[内訳]は、プラセボ群では1例(1.3%)[休薬:1例(1.3%)に1件(原発性胆汁性胆管炎)、投与中止及び減量:なし]、ミチーガ30mg群では4例(5.2%)[投与中止:2例(2.6%)に2件(皮膚炎及び皮膚剥脱が各1件)、休薬:2例(2.6%)に4件(貨幣状湿疹、手皮膚炎、爪肥厚及び表皮肥厚が各1件)、減量:なし]、ミチーガ60mg群では3例(3.9%)[投与中止:2例(2.6%)に2件(全身性剥脱性皮膚炎及び紅斑が各1件)、休薬:1例(1.3%)に1件(湿疹)、減量:なし]に認められた。副作用発現状況(SAF)
プラセボ群
(n=76)ミチーガ30mg群
(n=77)ミチーガ60mg群
(n=76)全副作用 9(11.8) 23(29.9) 16(21.1) 重篤な副作用 0 0 0 死亡に至った副作用 0 0 0 治療の調整に至った副作用 1(1.3) 4(5.2) 3(3.9) 投与中止 0 2(2.6) 2(2.6) 休薬 1(1.3) 2(2.6) 1(1.3) 減量 0 0 0 注目すべき副作用 注射関連の反応 0 2(2.6) 1(1.3) 喘息 0 0 0 アトピー性皮膚炎(悪化又は再燃を含む) 0 1(1.3) 3(3.9) 浮腫性紅斑又は鱗屑を伴う皮膚症状 0 8(10.4) 4(5.3) 皮膚感染症 2(2.6) 1(1.3) 1(1.3) 皮膚以外の感染症 0 0 0 治験薬からの感染病原体感染の疑い 0 0 0 例数(%)MedDRA/J Version 23.1
主な副作用
主な副作用(いずれかの群で2%以上に発現)は、プラセボ群では神経皮膚炎、ミチーガ30mg群では湿疹、紅斑、貨幣状湿疹、神経皮膚炎、皮膚炎、アトピー性皮膚炎、ミチーガ60mg群では湿疹、アトピー性皮膚炎、神経皮膚炎、紅斑であった。
主な副作用(いずれかの群で2%以上に発現した副作用)(SAF)
| プラセボ群 (n=76) |
ミチーガ30mg群 (n=77) |
ミチーガ60mg群 (n=76) |
|
|---|---|---|---|
| 皮膚および皮下組織障害 | |||
| 神経皮膚炎 | 5(6.6) | 2(2.6) | 2(2.6) |
| 湿疹 | 0 | 4(5.2) | 3(3.9) |
| 紅斑 | 0 | 4(5.2) | 2(2.6) |
| アトピー性皮膚炎 | 0 | 1(1.3) | 3(3.9) |
| 貨幣状湿疹 | 0 | 3(3.9) | 0 |
| 皮膚炎 | 0 | 2(2.6) | 0 |
同一患者で同じ副作用が複数回発現した場合、発現例数は1件としてカウントした。
MedDRA/J Version 23.1
有効性 Part A/B(投与開始68週まで)
かゆみ評価(PP-NRS、かゆみスコア)
PP-NRS変化率の経時推移(長期投与期間FAS)(その他の評価項目)
投与開始16週後、32週後、44週後及び68週後のベースラインからのPP-NRS変化率(平均値)は、プラセボ/ミチーガ30mg群※では-17.11%、-67.40%、-70.90%及び-78.38%、ミチーガ30mg群では-60.50%、-73.00%、-74.11%及び-78.59%であった。
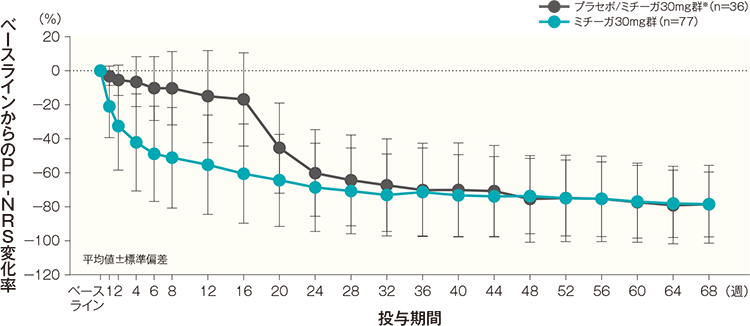
- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
- PP-NRS週平均が4以上改善した患者の割合(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のPP-NRS週平均がベースラインから4以上改善した患者の割合は、プラセボ/ミチーガ30mg群※では11.1%、63.9%、69.4%及び75.0%、ミチーガ30mg群では62.3%、74.0%、75.3%及び71.4%であった。
PP-NRS週平均が4以上改善した患者の割合(長期投与期間FAS) 記事/インライン画像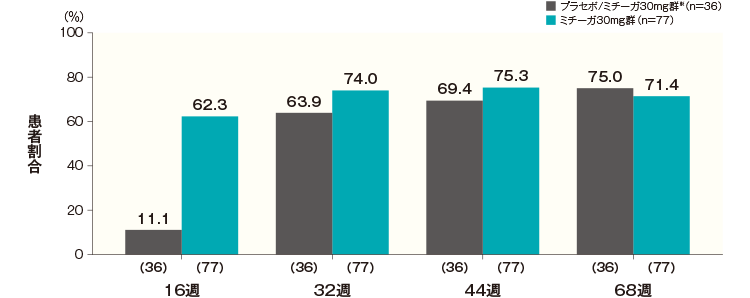 PP-NRSの詳細はこちら
PP-NRSの詳細はこちら- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
- ベースラインのPP-NRS週平均が4以上の患者について解析した。
- 横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
- PP-NRS-50達成率、PP-NRS-75達成率、PP-NRS-90達成率(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のPP-NRS-50達成率は、プラセボ/ミチーガ30mg群※では11.1%、63.9%、72.2%及び75.0%、ミチーガ30mg群では61.0%、74.0%、74.0%及び70.1%であった。
投与開始16週後、32週後、44週後及び68週後のPP-NRS-75達成率は、プラセボ/ミチーガ30mg群※では5.6%、38.9%、41.7%及び61.1%、ミチーガ30mg群では31.2%、51.9%、54.5%及び48.1%であった。
投与開始16週後、32週後、44週後及び68週後のPP-NRS-90達成率は、プラセボ/ミチーガ30mg群※では2.8%、19.4%、22.2%及び19.4%、ミチーガ30mg群では13.0%、22.1%、18.2%及び24.7%であった。記事/インライン画像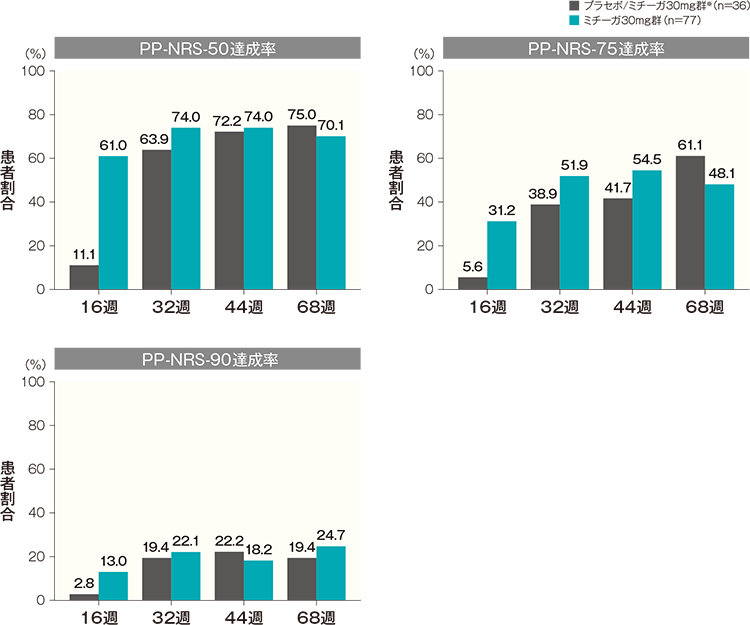 PP-NRSの詳細はこちら
PP-NRSの詳細はこちら- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
- 横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
かゆみスコアが1以下になった患者の割合(長期投与期間FAS)(その他の評価項目)
投与開始16週後、32週後、44週後及び68週後のかゆみスコアが1以下になった患者の割合は、プラセボ/ミチーガ30mg群※では5.6%、36.1%、47.2%及び52.8%、ミチーガ30mg群では32.5%、40.3%、44.2%及び41.6%であった。
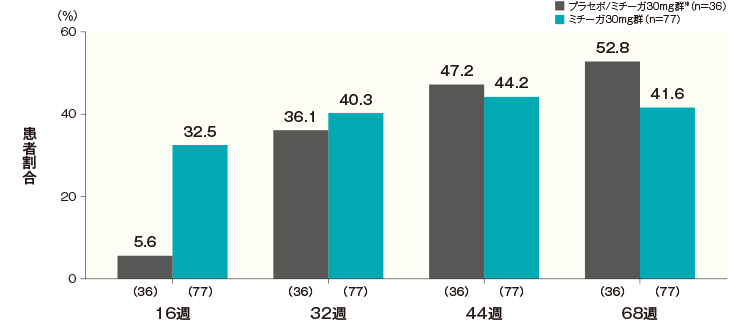
- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
- 横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
- かゆみスコア変化量の経時推移(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のベースラインからのかゆみスコア変化量(平均値)は、プラセボ/ミチーガ30mg群※では-0.62、-2.20、-2.14及び-2.38、ミチーガ30mg群では-1.66、-1.94、-2.03及び-2.14であった。
ベースラインからのかゆみスコアの変化量の経時推移(長期投与期間FAS) 記事/インライン画像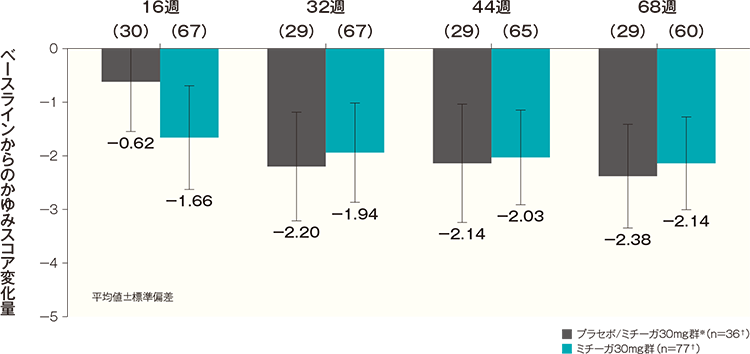 かゆみスコアの詳細はこちら
かゆみスコアの詳細はこちら- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
- †:
- ベースラインでの症例数を示す。各評価時点の症例数はグラフ横軸上のカッコ内に示すとおりであった。
皮膚症状の評価(PN-IGA、結節性痒疹数)
PN-IGAスコアが2段階以上改善かつ1以下になった患者の割合(長期投与期間FAS)(その他の評価項目)
投与開始16週後、32週後、44週後及び68週後のPN-IGAスコアがベースラインから2段階以上改善かつ1以下になった患者の割合は、プラセボ/ミチーガ30mg群※では5.6%、47.2%、61.1%及び77.8%、ミチーガ30mg群では41.6%、53.2%、55.8%及び70.1%であった。
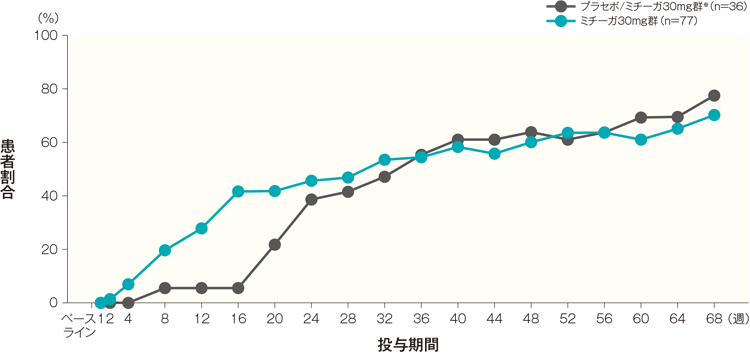
- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
結節性痒疹数の変化率の経時推移(代表的部位、頭頚部を除く全身、上肢、下肢、体幹)(長期投与期間FAS)(その他の評価項目)
ベースラインからの結節性痒疹数の変化率(代表的部位、頭頚部を除く全身、上肢、下肢、体幹)はA)~E)のとおり推移した。投与開始68週後のベースラインからの結節性痒疹数の変化率(平均値)は、プラセボ/ミチーガ30mg群※では、代表的部位が-95.94%、頭頚部を除く全身が-95.02%、上肢が-94.30%、下肢が-94.53%、体幹が-94.36%、ミチーガ30mg群ではそれぞれ-92.97%、-94.51%、-94.28%、-94.81%、-95.60%であった。
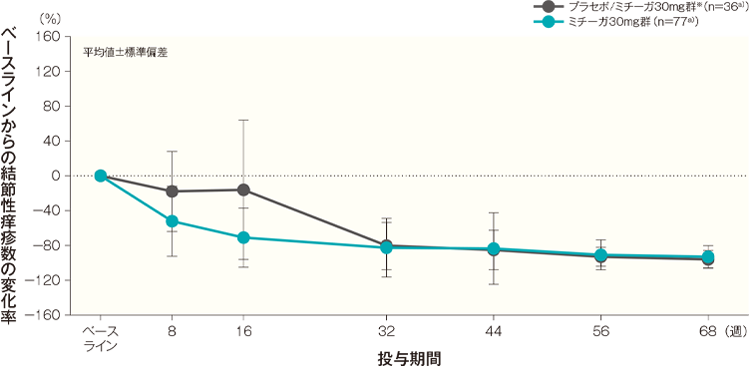
- 結節性痒疹数の変化率の経時推移(頭頚部を除く全身、上肢、下肢、体幹)(長期投与期間FAS)
-
B)頭頚部を除く全身 記事/インライン画像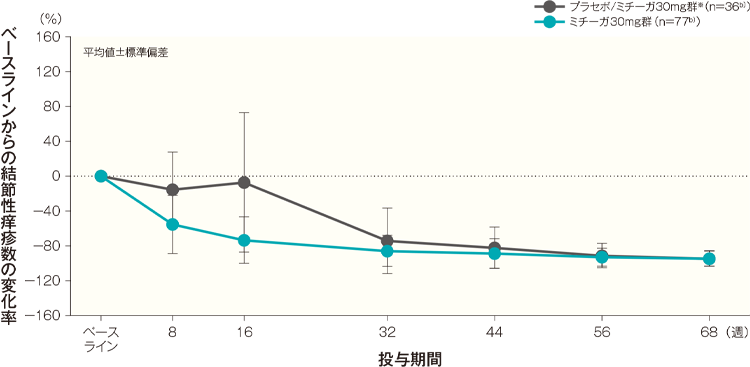
C)上肢 記事/インライン画像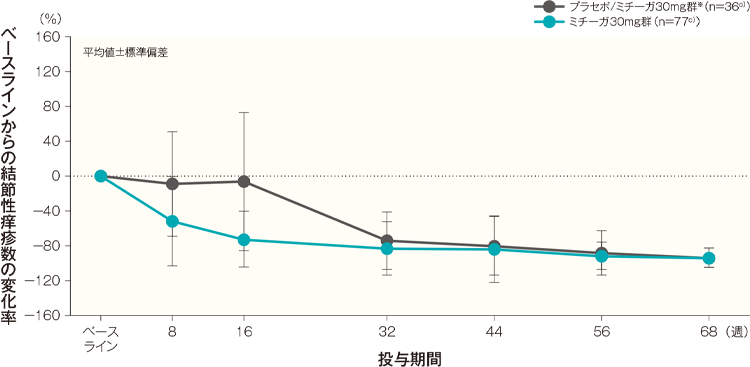
D)下肢 記事/インライン画像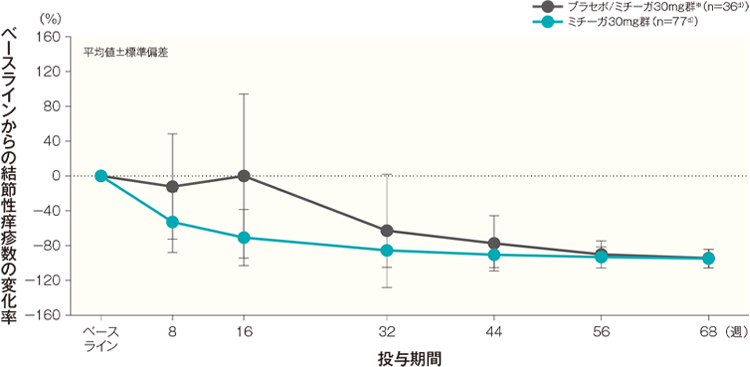
E)体幹 記事/インライン画像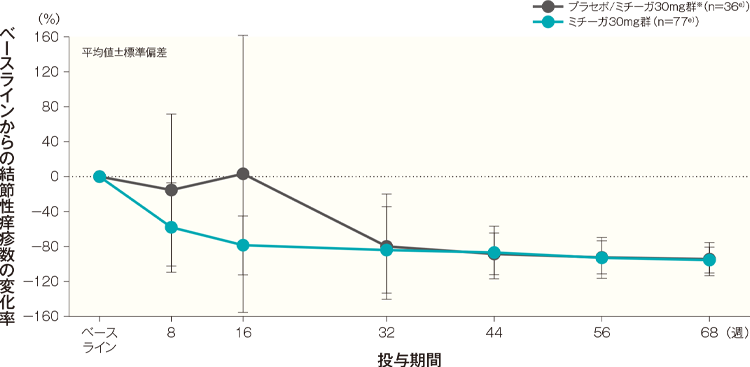
- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
- a):
- ベースラインでの症例数を示す。投与開始8週後、16週後、32週後、44週後、56週後、68週後の症例数は、プラセボ/ミチーガ30mg群がそれぞれ36例、36例、35例、35例、35例、35例、ミチーガ30mg群がそれぞれ76例、72例、71例、69例、67例、65例であった。
- b):
- ベースラインでの症例数を示す。投与開始8週後、16週後、32週後、44週後、56週後、68週後の症例数は、プラセボ/ミチーガ30mg群がそれぞれ36例、36例、35例、35例、35例、35例、ミチーガ30mg群がそれぞれ76例、72例、71例、69例、67例、65例であった。
- c):
- ベースラインでの症例数を示す。投与開始8週後、16週後、32週後、44週後、56週後、68週後の症例数は、プラセボ/ミチーガ30mg群がそれぞれ36例、36例、35例、35例、35例、35例、ミチーガ30mg群がそれぞれ75例、71例、70例、68例、66例、64例であった。
- d):
- ベースラインでの症例数を示す。投与開始8週後、16週後、32週後、44週後、56週後、68週後の症例数は、プラセボ/ミチーガ30mg群がそれぞれ36例、36例、35例、35例、35例、35例、ミチーガ30mg群がそれぞれ74例、70例、70例、67例、65例、63例であった。
- e):
- ベースラインでの症例数を示す。投与開始8週後、16週後、32週後、44週後、56週後、68週後の症例数は、プラセボ/ミチーガ30mg群がそれぞれ29例、29例、29例、29例、29例、29例、ミチーガ30mg群がそれぞれ69例、65例、64例、62例、60例、58例であった。
QOL評価(ISI、DLQI、WPAI-GH)
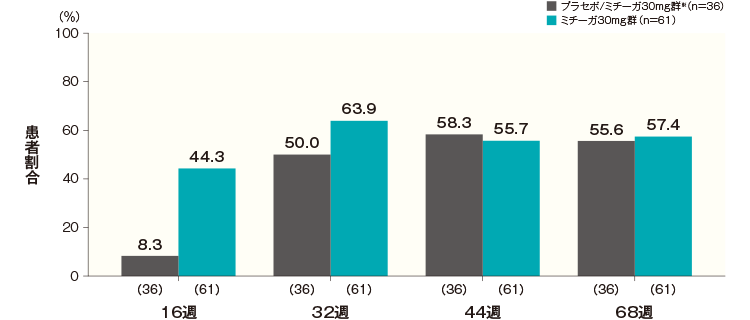
ISI合計スコアが7以下になった患者の割合(長期投与期間FAS)(その他の評価項目)
投与開始16週後、32週後、44週後及び68週後のISI合計スコアが7以下になった患者の割合は、プラセボ/ミチーガ30mg群※では8.3%、50.0%、58.3%及び55.6%、ミチーガ30mg群では44.3%、63.9%、55.7%及び57.4%であった。
- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
- 同意取得時の年齢が15歳以上かつベースラインのISI合計スコアが8以上の患者について解析した。
- 横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
- DLQI合計スコアが4以上改善した患者の割合(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のDLQI合計スコアがベースラインから4以上改善した患者の割合は、プラセボ/ミチーガ30mg群※では45.7%、88.6%、82.9%及び91.4%、ミチーガ30mg群では77.8%、84.7%、81.9%及び75.0%であった。
DLQI合計スコアがベースラインから4以上改善した患者の割合(長期投与期間FAS) 記事/インライン画像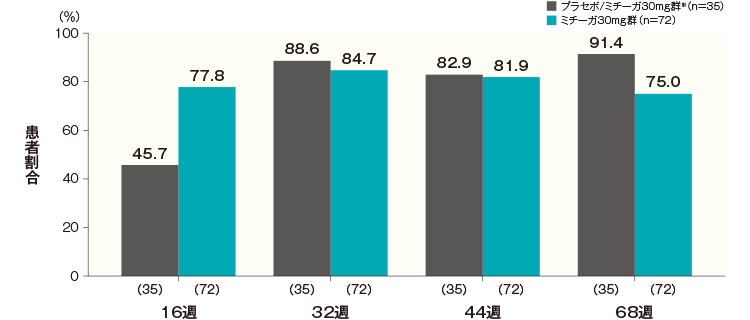 DLQIの詳細はこちら
DLQIの詳細はこちら- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
- ベースラインのDLQI合計スコアが4以上の患者について解析した。
- 同意取得日の年齢が16歳未満の患者は、治験期間を通じてCDLQIを用いて評価した。
- 横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
- 仕事の生産性と活動性の低下:WPAI-GH(Q7~Q10)の経時推移(長期投与期間FAS)(その他の評価項目)
-
投与開始68週後までのWPAI-GHの「Q7:労働時間損失率(Work time missed)」、「Q8:労働能率低下率(Impairment while working)」、「Q9:全般労働障害率(Overall work impairment)」及び「Q10:日常活動性障害率(Activity impairment)」は以下のとおり推移し、投与開始68週後の平均値は、プラセボ/ミチーガ30mg群※では、それぞれ2.78%、17.08%、18.47%及び17.14%、ミチーガ30mg群では、それぞれ0.81%、9.76%、10.29%及び11.23%であった。
WPAI-GH(Q7~Q10)の経時推移(長期投与期間FAS) 記事/インライン画像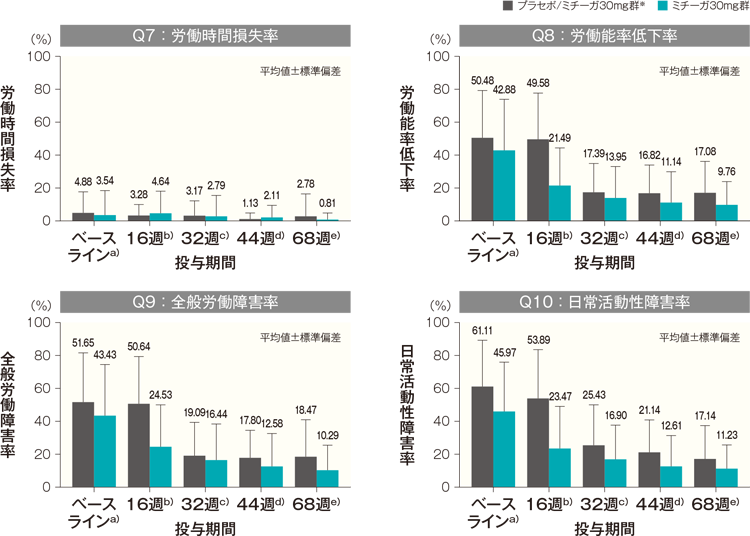
- ※:
- プラセボ/ミチーガ30mg群は16週までプラセボを、それ以降はミチーガ30mg(初回のみ60mg)の投与を行った。
- 同意取得時の年齢が15歳を超える患者について解析した。
WPAI-GHの詳細はこちら- a)
- プラセボ/ミチーガ30mg群 Q7~Q9:n=21、Q10:n=36、ミチーガ30mg群 Q7:n=53、Q8・Q9:n=52、Q10:n=77
- b)
- プラセボ/ミチーガ30mg群 Q7~Q9:n=24、Q10:n=36、ミチーガ30mg群 Q7~Q9:n=47、Q10:n=72
- c)
- プラセボ/ミチーガ30mg群 Q7~Q9:n=23、Q10:n=35、ミチーガ30mg群 Q7~Q9:n=43、Q10:n=71
- d)
- プラセボ/ミチーガ30mg群 Q7~Q9:n=22、Q10:n=35、ミチーガ30mg群 Q7~Q9:n=44、Q10:n=69
- e)
- プラセボ/ミチーガ30mg群 Q7~Q9:n=24、Q10:n=35、ミチーガ30mg群 Q7~Q9:n=41、Q10:n=65
安全性 Part A/B期間全体
- 副作用発現状況
-
副作用は、プラセボ/ミチーガ30mg群※では35例中16例(45.7%)に31件、プラセボ/ミチーガ60mg群※では37例中12例(32.4%)に22件、ミチーガ30mg群では77例中30例(39.0%)に85件、ミチーガ60mg群では76例中33例(43.4%)に82件認められた。
本試験において、死亡に至った副作用は認められなかった。
重篤な副作用は、ミチーガ60mg群では2例(2.6%)に3件(肝障害、肺水腫及び肺障害が各1件)認められ、プラセボ/ミチーガ30mg群※、プラセボ/ミチーガ60mg群※及びミチーガ30mg群では認められなかった。
治療の調整に至った副作用[内訳]は、プラセボ/ミチーガ30mg群※では3例(8.6%)[休薬:3例(8.6%)に3件(関節痛、バセドウ病、原発性胆汁性胆管炎が各1件)、投与中止及び減量:なし]、プラセボ/ミチーガ60mg群※では2例(5.4%)[休薬:2例(5.4%)に3件(紅斑2件、注射部位反応1件)、投与中止及び減量:なし]、ミチーガ30mg群では6例(7.8%)[投与中止:2例(2.6%)に2件(皮膚炎及び皮膚剥脱が各1件)、休薬:4例(5.2%)に7件(貨幣状湿疹、手皮膚炎、爪肥厚、表皮肥厚、湿疹、中毒性皮疹、びまん性脱毛症が各1件)、減量:なし]、ミチーガ60mg群では5例(6.6%)[投与中止:3例(3.9%)に3件(咽頭浮腫、紅斑、全身性剥脱性皮膚炎が各1件)、休薬:2例(2.6%)に3件(湿疹、肝障害、エプスタイン・バーウイルス感染が各1件)、減量:なし]に認められた。副作用発現状況(長期投与期間SAF)
プラセボ/
ミチーガ
30mg群※
(n=35)プラセボ/
ミチーガ
60mg群※
(n=37)ミチーガ
30mg群
(n=77)ミチーガ
60mg群
(n=76)全副作用 16(45.7) 12(32.4) 30(39.0) 33(43.4) 重篤な副作用 0 0 0 2(2.6) 死亡に至った副作用 0 0 0 0 治療の調整に至った副作用 3(8.6) 2(5.4) 6(7.8) 5(6.6) 投与中止 0 0 2(2.6) 3(3.9) 休薬 3(8.6) 2(5.4) 4(5.2) 2(2.6) 減量 0 0 0 0 注目すべき副作用 注射関連の反応 0 2(5.4) 3(3.9) 2(2.6) 喘息 0 0 0 1(1.3) アトピー性皮膚炎(悪化又は再燃を含む) 0 0 1(1.3) 5(6.6) 浮腫性紅斑又は鱗屑を伴う皮膚症状 2(5.7) 4(10.8) 9(11.7) 8(10.5) 皮膚感染症 2(5.7) 0 2(2.6) 4(5.3) 皮膚以外の感染症 1(2.9) 0 1(1.3) 3(3.9) 治験薬からの感染病原体感染の疑い 0 0 0 0 結節性痒疹の悪化 2(5.7) 4(10.8) 2(2.6) 2(2.6) 例数(%)- ※:
- プラセボ/ミチーガ30mg群及びプラセボ/ミチーガ60mg群は、16週までプラセボを、それ以降はそれぞれミチーガ30mg(初回のみ60mg)及びミチーガ60mgの投与を行った。
MedDRA/J Version 23.1
主な副作用
主な副作用(いずれかの群で2%以上に発現)は、プラセボ/ミチーガ30mg群※では湿疹、貨幣状湿疹、神経皮膚炎、蕁麻疹、便秘など、プラセボ/ミチーガ60mg群※では紅斑、神経皮膚炎、貨幣状湿疹、注射部位反応など、ミチーガ30mg群では湿疹、貨幣状湿疹、紅斑など、ミチーガ60mg群では湿疹、アトピー性皮膚炎、貨幣状湿疹などであった。
主な副作用(いずれかの群で2%以上に発現した副作用)(SAF)
| プラセボ/ミチーガ 30mg群※ (n=35) |
プラセボ/ミチーガ 60mg群※ (n=37) |
ミチーガ 30mg群 (n=77) |
ミチーガ 60mg群 (n=76) |
|
|---|---|---|---|---|
| 皮膚および皮下組織障害 | 11(31.4) | 11(29.7) | 27(35.1) | 24(31.6) |
| 湿疹 | 5(14.3) | 1(2.7) | 7(9.1) | 7(9.2) |
| 貨幣状湿疹 | 2(5.7) | 2(5.4) | 6(7.8) | 4(5.3) |
| 紅斑 | 0 | 4(10.8) | 5(6.5) | 3(3.9) |
| 丘疹 | 1(2.9) | 0 | 3(3.9) | 2(2.6) |
| 神経皮膚炎 | 2(5.7) | 4(10.8) | 2(2.6) | 2(2.6) |
| 皮膚炎 | 0 | 0 | 2(2.6) | 0 |
| アトピー性皮膚炎 | 0 | 0 | 1(1.3) | 5(6.6) |
| 蕁麻疹 | 2(5.7) | 1(2.7) | 0 | 3(3.9) |
| 好酸球増多を伴う血管リンパ組織過形成 | 1(2.9) | 0 | 0 | 0 |
| 発疹 | 0 | 1(2.7) | 0 | 1(1.3) |
| 紅斑性皮疹 | 0 | 1(2.7) | 0 | 0 |
| 剥脱性発疹 | 0 | 1(2.7) | 0 | 0 |
| 胃腸障害 | 3(8.6) | 2(5.4) | 3(3.9) | 1(1.3) |
| 下痢 | 0 | 1(2.7) | 1(1.3) | 1(1.3) |
| 腹部不快感 | 0 | 1(2.7) | 1(1.3) | 0 |
| 便秘 | 2(5.7) | 0 | 0 | 0 |
| 口唇腫脹 | 1(2.9) | 0 | 0 | 0 |
| 一般・全身障害および投与部位の状態 | 1(2.9) | 3(8.1) | 3(3.9) | 4(5.3) |
| 注射部位反応 | 0 | 2(5.4) | 2(2.6) | 0 |
| 顔面浮腫 | 1(2.9) | 0 | 0 | 0 |
| 末梢性浮腫 | 0 | 1(2.7) | 0 | 2(2.6) |
| 感染症および寄生虫症 | 3(8.6) | 0 | 2(2.6) | 6(7.9) |
| 蜂巣炎 | 1(2.9) | 0 | 2(2.6) | 1(1.3) |
| 毛包炎 | 0 | 0 | 1(1.3) | 2(2.6) |
| 帯状疱疹 | 1(2.9) | 0 | 0 | 0 |
| 麦粒腫 | 1(2.9) | 0 | 0 | 0 |
| 外耳炎 | 1(2.9) | 0 | 0 | 0 |
| 創傷感染 | 1(2.9) | 0 | 0 | 0 |
| 筋骨格系および結合組織障害 | 1(2.9) | 0 | 0 | 2(2.6) |
| 関節痛 | 1(2.9) | 0 | 0 | 2(2.6) |
| 肝胆道系障害 | 1(2.9) | 0 | 0 | 1(1.3) |
| 原発性胆汁性胆管炎 | 1(2.9) | 0 | 0 | 0 |
| 内分泌障害 | 1(2.9) | 0 | 0 | 0 |
| バセドウ病 | 1(2.9) | 0 | 0 | 0 |
同一患者で同じ副作用が複数回発現した場合、発現例数は1件としてカウントした。
- ※:
- プラセボ/ミチーガ30mg群及びプラセボ/ミチーガ60mg群は、16週までプラセボを、それ以降はそれぞれミチーガ30mg(初回のみ60mg)及びミチーガ60mgの投与を行った。
MedDRA/J Version 23.1
-
- 臨床検査(アトピー性皮膚炎バイオマーカー:TARC)
-
TARC値
ミチーガ30mg群及びミチーガ60mg群では、投与開始2週後から4週後にかけて血清TARC値が上昇し、その後は経時的に低下し、投与開始68週後は投与開始前と同程度の値となった。
プラセボ/ミチーガ30mg群※及びプラセボ/ミチーガ60mg群※では、投与開始16週後にミチーガの投与を開始すると、投与開始20週後(ミチーガ投与開始4週後)から24週後(ミチーガ投与開始8週後)にかけて血清TARC値が上昇し、その後は経時的に低下した。血清TARC値(中央値)の経時推移(長期投与期間SAF) 記事/インライン画像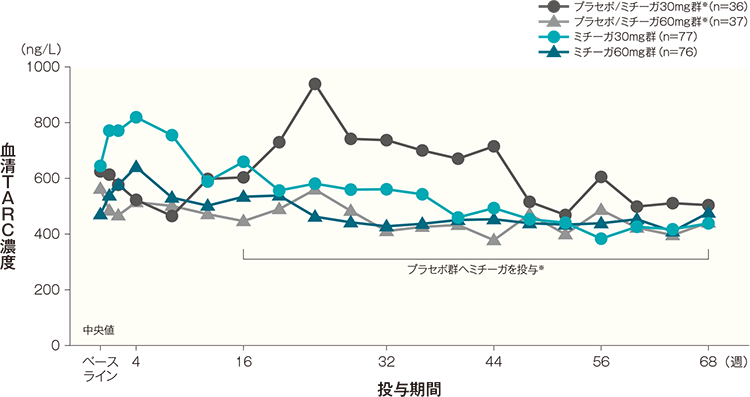
- ※:
- プラセボ/ミチーガ30mg群及びプラセボ/ミチーガ60mg群は、16週までプラセボを、それ以降はそれぞれミチーガ30mg(初回のみ60mg)及びミチーガ60mgの投与を行った。
- TARC値と結節性痒疹数及びPP-NRSの相関性
-
ミチーガ投与後にみられた血清TARC値の上昇に伴って病状が変化しているかを確認するため、投与開始8週後及び16週後の血清TARC値の変化率と結節性痒疹数の変化率(頭頚部を除く全身)及びPP-NRS変化率の相関性を検討した。
ミチーガ30mg群、ミチーガ60mg群及びプラセボ群で、血清TARC値の変化率と結節性痒疹数の変化率の間、及び血清TARC値の変化率とPP-NRS変化率の間に相関性はみられなかった。血清TARC値と結節性痒疹数の相関性(SAF) <投与開始8週後>
記事/インライン画像
<投与開始16週後>
記事/インライン画像
血清TARC値とPP-NRSの相関性(SAF) <投与開始8週後>
記事/インライン画像
<投与開始16週後>
記事/インライン画像
- 5. 効能・効果に関連する注意(抜粋)
〈結節性痒疹〉 -
- 5.5
- 「17.臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景を十分に理解した上で、ステロイド外用剤等の抗炎症外用剤及び抗ヒスタミン剤等の抗アレルギー剤による適切な治療を一定期間施行しても、痒疹結節を主体とする病変が多発し、複数の部位に及ぶ患者に投与すること。[17.1.2参照]
- 5.6
- 最新の診療ガイドライン等を参考に、臨床症状及び全身検索に基づいて他の皮膚疾患との鑑別を行うこと。
- 6. 用法・用量(抜粋)
〈結節性痒疹〉 -
- 通常、成人及び13歳以上の小児にはネモリズマブ(遺伝子組換え)として初回に60mgを皮下投与し、以降1回30mgを4週間の間隔で皮下投与する。
- 7. 用法・用量に関連する注意
-
- 7.1
- 本剤投与後に浮腫性紅斑、湿疹等の発現を含む、皮膚症状の悪化が認められているので、皮膚症状が悪化した場合には、本剤の継続の可否について慎重に検討すること。
- 7.2
- 本剤とミチーガ皮下注用60mgシリンジの生物学的同等性は示されていないことから、互換使用を行わないこと。



