小児アトピー性皮膚炎患者(6歳以上13歳未満)を対象とした第Ⅲ相比較/長期継続投与試験
第Ⅲ相比較/長期継続投与試験(M525101-04試験)
(1)試験概要
- 目的
-
主要な目的
- Part A:
- 既存治療を実施したにもかかわらず中等度以上のそう痒(かゆみスコア3以上)を有する6歳以上13歳未満の日本人のアトピー性皮膚炎患者に対するミチーガの有効性を、プラセボを対照としたランダム化、二重盲検、並行群間比較試験で検証する。有効性の主要評価項目は、投与開始16週後のかゆみスコア変化量とする。
- Part B:
- Part Aを完了した患者を対象に、ミチーガを長期投与(52週間)した際の安全性を評価する。安全性は、有害事象、臨床検査、バイタルサイン及び心電図で評価する。
副次的目的
- Part A:
- 既存治療を実施したにもかかわらず中等度以上のそう痒(かゆみスコア3以上)を有する6歳以上13歳未満のアトピー性皮膚炎患者に対するミチーガの安全性を、プラセボを対照としたランダム化二重盲検並行群間比較試験で評価する。
- Part B:
- Part Aを完了した患者を対象に、ミチーガを長期投与(52週間)した際の有効性を評価する。
- 対象
- 既存治療を実施したにもかかわらず中等度以上のそう痒(かゆみスコア3以上)を有する6歳以上13歳未満の小児アトピー性皮膚炎患者
- 選択基準
-
- 同意取得日の年齢が6歳以上13歳未満のアトピー性皮膚炎と診断された患者
- 同意取得時点での外用治療:過去1年以内にアトピー性皮膚炎に対して、適切なランクのステロイド外用剤又はタクロリムス軟膏を固定の用法で4週間以上使用したが、そう痒が残存していた(医師がかゆみスコア3以上と判断した)患者
- 同意取得時点での抗ヒスタミン剤又は抗アレルギー剤による内服治療:過去1年以内にアトピー性皮膚炎のそう痒に対して、抗ヒスタミン剤又は抗アレルギー剤を固定の用法・用量で2週間以上投与したが、そう痒が残存していた(医師がかゆみスコア3以上と判断した)患者、若しくは抗ヒスタミン剤又は抗アレルギー剤で治療できない患者(過敏症・禁忌等)
- 登録日のかゆみスコアが3以上の患者
- ランダム化日の2日前からランダム化日の3日間のかゆみスコアのうち、2日が3以上、かつ残りの1日が2以上の患者 等
- 除外基準
-
- 重篤な心・肝・腎・肺・血液疾患等、治験参加に不適当と考えられる疾患を合併している患者
- 悪性腫瘍を既往又は合併している患者
- ランダム化日の体重が15.0kg未満の患者
- ランダム化日前の28日以内に全身性のステロイド剤、免疫抑制剤、アトピー性皮膚炎の皮疹部に対する光線療法、変調療法、アレルゲン免疫療法(既承認の舌下免疫療法は、用法・用量が固定された維持期の場合、実施可)、生ワクチン、食物経口負荷試験を実施した患者
- ランダム化日前の14日以内にアトピー性皮膚炎に対する薬剤・療法を実施した患者(ただし次の場合は実施可:保湿・保護剤;weakクラスのステロイド外用剤;mediumクラスのステロイド外用剤、strongクラスのステロイド外用剤又はタクロリムス外用剤0.03%を固定薬剤及び固定用法で継続して治療;全身性の抗ヒスタミン剤・抗アレルギー剤を固定薬剤及び固定用法・用量で継続して治療)
- ランダム化日前の14日以内にアトピー性皮膚炎以外のそう痒治療を目的とした全身性の薬剤を投与した患者
- ランダム化日のEASIが10未満の患者 等
- 症例数
-
- Part A:
- 89例(ミチーガ群45例、プラセボ群44例)
- Part B:
- 88例(ミチーガ群44例、プラセボ/ミチーガ群44例)
- 投与方法
-
Part A(治療期間:16週間):
ランダム化日(投与開始日)、4、8及び12週後来院時に、ミチーガ30mga)又はプラセボを、上腕部、腹部又は大腿部のうち、病変のない皮膚を選択し、皮下投与した。Part B(治療期間:52週間):
16週後来院時以降、64週後来院時まで4週ごとにミチーガ30mga)を、上腕部、腹部又は大腿部のうち、病変のない皮膚を選択し、皮下投与したb)。 - 評価項目
-
<有効性>
- 主要評価項目(Part A)
- 投与開始16週後のかゆみスコア変化量(検証的な解析項目)
- 副次評価項目(Part A)
- 投与開始2週後までの各日のかゆみスコア変化量の経時推移
- 投与開始16週後のかゆみスコアが1以下になった患者の割合
- 投与開始16週後のそう痒NRS変化率
- 投与開始16週後のEASI変化率
- 投与開始16週後のPOEM合計スコアが4以上改善した患者の割合
- 投与開始16週後のCDLQI変化量
- その他の評価項目
-
- 経時推移:
- かゆみスコア、そう痒NRS、EASI、POEM、痒疹数、CDLQI、DFI 等
-
- 改善割合:
- かゆみスコアが1以下になった患者の割合、そう痒NRSが4以上改善した患者の割合、そう痒NRS-50達成率、そう痒NRS-75達成率、EASI-50達成率、EASI-75達成率、POEM合計スコアが4以上改善した患者の割合、CDLQI合計スコアが2.5以上改善した患者の割合 等
- ステロイド外用剤及びタクロリムス外用剤の使用量 等
<安全性>
有害事象、臨床検査、バイタルサイン、心電図、免疫原性(血清中抗ネモリズマブ抗体)
<薬物動態>
血清中ネモリズマブ濃度
- 解析計画
-
- 解析計画
-
<有効性>
- 主要評価項目(Part A)
- 投与開始16週後のかゆみスコア変化量は、Full analysis set(FAS)を対象に、混合効果モデル(MMRM)を用いて、投与群、時点ごとにかゆみスコア変化量の最小二乗平均値、標準誤差(SE)、両側95%信頼区間(CI)、及びミチーガ群とプラセボ群の差の最小二乗平均値、SE、両側95%CI及びp値を算出した。ベースラインからのかゆみスコア変化量はマイナス方向ほど改善傾向を意味するため、差の95%上側信頼限界値が0を下回っていた場合、プラセボに対する優越性が検証されたと判断した。さらに、MMRMを用いて、応答変数を生値に変更したもとで、投与群、時点ごとの最小二乗平 均値、SE、両側95%CIを算出した。ベースラインのデータは共変量に用いず、応答変数ベクトルに含めた。アトピー性皮膚炎の悪化でレスキュー治療を行った後のデータは欠測とした。また、主要評価項目の主解析では、観測した経時データをMMRMで解析するため、欠測データは補完しなかった。
- 副次評価項目(Part A)
投与開始2週後までの各日のかゆみスコア変化量は、MMRMを用いて、投与群、日ごとの最小二乗平均値、SE、両側95%CIを算出した。投与開始16週後のかゆみスコアが1以下になった患者の割合(かゆみスコア週平均が1以下となった患者を対象)及び投与開始16週後のPOEM合計スコアが4以上改善した患者の割合(ベースラインのPOEM合計スコアが4以上の患者を対象)は、例数及び割合を投与群、時点ごとに求め、さらに割合の群間差とその両側95%CI、Fisherの正確検定による両側p値を算出した。投与開始16週後のそう痒NRS変化率、投与開始16週後のEASI変化率、及び投与開始16週後のCDLQI変化量は、主要評価項目と同様にMMRMを用いて解析した。連続データの解析では、主要評価項目と同様にMMRMにより解析するため、欠測は補完しなかった。二値データの解析では、欠測はノンレスポンダーを補完した。
- その他の評価項目
その他の評価項目に関しては、特に記載のない限り、欠測は補完しなかった。
-
- 経時推移:
- 長期投与期間FAS(Part A/B)を対象に、連続変数[かゆみスコア、EASI (部位別の皮膚所見スコア)、CDLQI(合計及び項目別スコア)、POEM(合計及び項目別スコア)、DFI (合計及び項目別スコア)、そう痒NRS、EASI (合計スコア及び部位別スコア)]は要約統計量を、離散変数[かゆみスコア、POEM(合計及び項目別スコア)、DFI(項目別のスコア)、痒疹数]は例数及び割合を、投与群、時点ごとに求めた。割合の分母は各時点の観測例数を用いた。DFI合計スコア変化量の解析では、時点ごと(Part Aのみ)にStudentのt検定により群間比較し、群間差とその両側95%CI及びp値を算出した。痒疹数の解析では各カテゴリを順序データと取り扱い、時点ごと(Part Aのみ)に2標本Wilcoxon検定により群間比較し、p値を算出した。
-
- 改善割合:
- 長期投与期間FAS(Part A/B)を対象に、以下に示す規定の基準まで改善した患者の割合を、投与群、時点ごとに求めた。さらにPart Aの集計では、割合の群間差とその両側95%CI、Fisherの正確検定による両側p値を算出した。
- かゆみスコア:1以下
- そう痒NRS:ベースラインから50%以上改善・75%以上改善(それぞれそう痒NRS-50達成率・そう痒NRS-75達成率)、ベースラインから4以上改善 等
- EAS I:ベースラインから50%以上改善・75%以上改善(それぞれEASI-50達成率・EASI-75達成率) 等
- POEM:ベースラインから合計スコア4以上改善
- CDLQ I:ベースラインから合計スコア2.5以上改善 等
- ステロイド外用剤及びタクロリムス外用剤の使用量:長期投与期間FAS(Part A/B)を対象に、ステロイド外用剤及びタクロリムス外用剤の各来院日間の1日当たりの使用量について、投与群別に使用期間ごとの使用量の要約統計量を算出した。
<安全性>
Part Aでは安全性解析対象集団(Safety analysis set:SAF)、Part A/Bでは長期投与期間SAFを解析対象とした。Part A/Bの集計にはフォローアップ期間に発現した有害事象も含めた。有害事象はMedDRA/J Version 23.0を用いて読み替えた。重要な有害事象は、治験薬の投与中止に至った有害事象(休薬・減量を含む)及び注目すべき有害事象とした。注目すべき有害事象は、a)注射関連の反応(注射部位の局所反応及び全身性の注射反応を含む)、b)喘息、c)アトピー性皮膚炎の悪化、d)アトピー性皮膚炎の悪化には該当しない浮腫性紅斑又は鱗屑を伴う皮膚症状、e)皮膚感染症、f)皮膚以外の感染症、g)治験薬からの感染病原体感染の疑い、と定義した。血清TARC値とEASI及びかゆみスコアの相関性については、投与開始4、8週後の血清TARC値の変化率とEASI変化率及びかゆみスコア変化量の散布図を投与群別に作成し、Pearson及びSpearmanの相関係数を算出した。
免疫原性:薬物動態解析対象集団を対象に、血清中抗ネモリズマブ抗体の試験結果を、試験(screening、confirmatory、neutralizing)、投与群、時点ごとに集計した。また、抗ネモリズマブ抗体陽性の患者の割合を投与群別に求めた。抗ネモリズマブ抗体陽性は、投与開始前のconfirmatory試験の結果が陰性又は欠測の患者ではミチーガ初回投与以降のconfirmatory試験の結果が陽性と判定された場合、投与開始前のconfirmatory試験の結果が陽性と判定された患者ではミチーガ初回投与以降のconfirmatory試験の結果が陽性と判定され、そのときの抗体価が投与開始前の4倍以上の場合と定義した。
- a)
- 本試験の用量(ミチーガ30mgを4週ごとに投与)は、第Ⅰ相試験(M525101-03試験)で得られた薬物動態を、ミチーガⓇ皮下注用60mgシリンジにおける健康成人及び成人アトピー性皮膚炎患者を対象とした第Ⅰ相単回投与試験(CIM001JP試験)と比較した結果、成人と小児で薬物動態が類似していたことと、6歳以上13歳未満の体重分布1)に基づき設定された。
- b)
- 投与開始44週後に13歳かつ治験薬投与日の体重が30.0kg以上の患者には、投与開始44週後以降はミチーガ60mg(ミチーガ®皮下注用30mgバイアルを2本使用)を皮下投与した。なお、ミチーガ®皮下注用30mgバイアルとミチーガ®皮下注用60mgシリンジの生物学的同等性は示されていない。治療開始時に13歳未満であった小児アトピー性皮膚炎患者に対し、13歳以降に引き続きミチーガを投与する場合は、ミチーガ®皮下注用60mgシリンジに切り替えて投与を行うこと。
1)文部科学省. 平成29年度学校保健統計調査による身体発育値及び発育曲線.
(2)試験デザイン
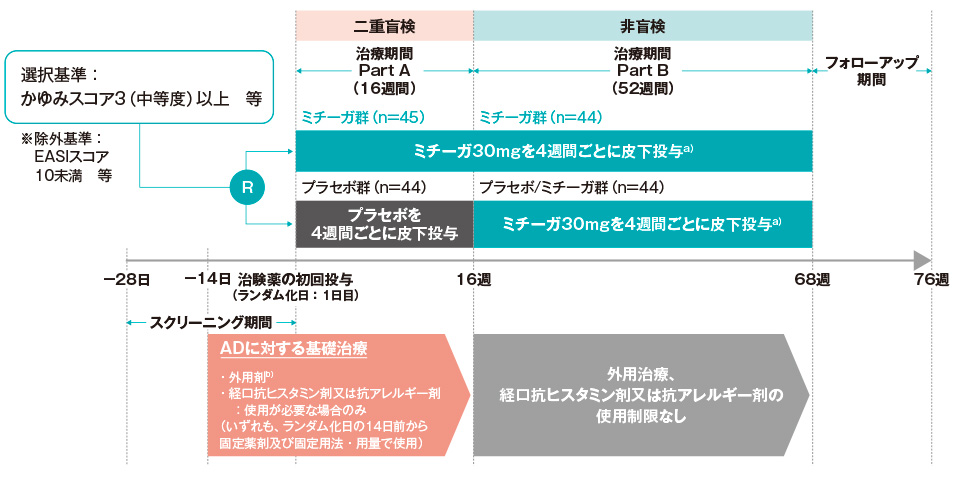
- R:
- ランダム化
- AD:
- アトピー性皮膚炎
- a)
- 投与開始44週後に13歳かつ治験薬投与日の体重が30.0kg以上の患者には、投与開始44週後以降はミチーガ60mg(ミチーガ®皮下注用30mgバイアルを2本使用)を皮下投与した。
- b)
- ランダム化日前の14日以内及びPart Aでは、保湿・保護剤、weakクラスのステロイド外用剤の使用が許容された。ランダム化日の14日以上前からmedium若しくはstrongクラスのステロイド外用剤又はタクロリムス外用剤0.03%を固定薬剤・固定用法で継続使用することも許可された。なお、本試験では、ランダム化日にアトピー性皮膚炎の基礎治療が適切に実施できている患者であることを選択基準の一つとして組み入れることとし、組み入れ時の基礎治療の規定は次のとおりとした:1)アトピー性皮膚炎に対する外用剤の基礎治療(アトピー性皮膚炎の皮疹に対して、mediumクラスのステロイド外用剤、strongクラスのステロイド外用剤又はタクロリムス外用剤0.03%を固定薬剤及び固定用法で継続して治療)、2)全身性の抗ヒスタミン剤・抗アレルギー剤を固定薬剤及び固定用法・用量で継続して治療。
(3)患者背景
⼈⼝統計学的及び他の基準値の特性(FAS)
| プラセボ群 (n=44) |
ミチーガ群 (n=45) |
|
|---|---|---|
| 性別:男性、例数(%) 女性、例数(%) |
24(54.5) 20(45.5) |
29(64.4) 16(35.6) |
| 年齢中央値、歳(範囲) | 9.0(6-12) | 9.0(6-12) |
| Strong クラスステロイド外用剤ありa)、例数(%) | 39(88.6) | 36(80.0) |
| タクロリムス外用剤あり、例数(%) | 18(40.9) | 10(22.2) |
| 経口抗ヒスタミン剤又は 抗アレルギー剤あり、例数(%) |
38(86.4) | 42(93.3) |
| 罹病期間中央値、年(範囲) | 8.22(1.3-12.0) | 8.89(3.0-13.3) |
| アレルギー疾患ありb)、例数(%) | 35(79.5) | 41(91.1) |
| 痒疹数:0個、例数(%) 1~9個、例数(%) 10~19個、例数(%) 20~49個、例数(%) 50~99個、例数(%) 100個以上、例数(%) |
9(20.5) 14(31.8) 2(4.5) 9(20.5) 7(15.9) 3(6.8) |
11(24.4) 11(24.4) 7(15.6) 9(20.0) 5(11.1) 2(4.4) |
| かゆみスコア中央値(範囲) | 3.00(2.3-4.0) | 3.00(2.8-4.0) |
| そう痒NRS中央値(範囲) | 6.79(4.1-10.0) | 6.57(3.3-9.9) |
| EASIスコア中央値(範囲) | 14.50(10.1-35.8) | 18.15(10.5-48.1) |
| sIGAスコア: 3以下、例数(%) 4以上、例数(%) |
34(77.3) 10(22.7) |
36(80.0) 9(20.0) |
| BSA中央値、%(範囲) | 31.0(11-75) | 40.0(20-80) |
| CDLQIスコア中央値(範囲) | 7.5(1-19) | 8.0(1-20) |
| POEMスコア中央値(範囲) | 16.0(2-28) | 18.0(5-28) |
| DFIスコア中央値(範囲) | 9.0(0-21) | 6.0(0-27) |
| 血清TARC値中央値、ng/L(範囲) | 840.0(145-3270) | 716.0(221-11500) |
- a)
- ランダム化日前の14日間で最も高いクラスのステロイド外用剤
- b)
- 気管支喘息、季節性アレルギー、アレルギー性鼻炎、アレルギー性結膜炎、食物アレルギー及び喘息の病歴又は合併症の少なくとも一つを有する患者
有効性 Part A(投与開始~16週)
かゆみ評価(かゆみスコア、そう痒NRS)
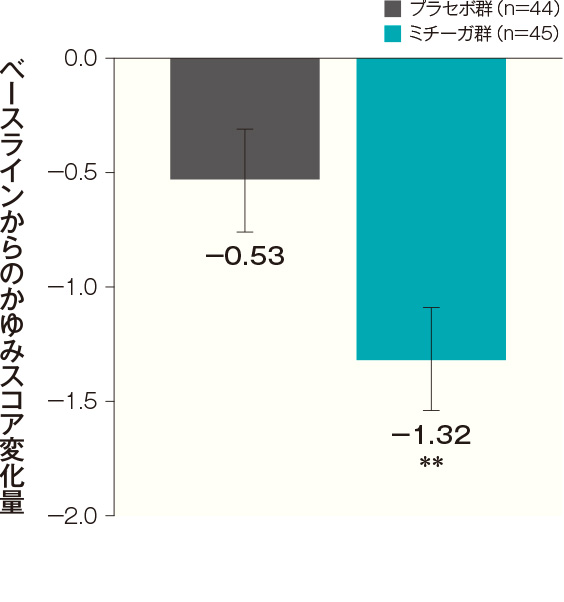
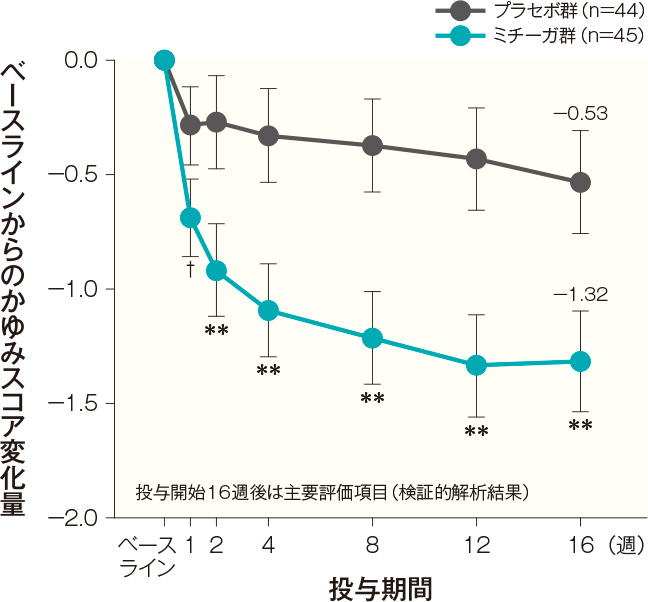
投与開始16週後のかゆみスコア変化量(主要評価項目:検証的解析結果)
投与開始16週後のベースラインからのかゆみスコア変化量(最小二乗平均値)は、プラセボ群では-0.53、ミチーガ群では-1.32であった。両群間の差(ミチーガ群-プラセボ群、最小二乗平均値)は-0.78(95%CI:-1.10~-0.47)であり、統計学的に有意な差が認められ(p<0.0001、MMRM※)、プラセボ群に対するミチーガ群の優越性が検証された。
最小二乗平均値±両側95%CI
†:p<0.01、**:p<0.0001、MMRM※(vs.プラセボ群)、投与開始16週後のp値(調整後)以外は名目上のp値
- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインのかゆみスコアを共変量とした。
- 投与開始2週後までの各日のかゆみスコア変化量の経時推移(FAS)(副次評価項目)
-
初回投与翌日(投与開始2日後)のベースラインからのかゆみスコア変化量(最小二乗平均値)は、プラセボ群では-0.25、ミチーガ群では-0.49であった(有意差なし:MMRM※)。
投与開始3日後のベースラインからのかゆみスコア変化量(最小二乗平均値)は、プラセボ群では-0.21、ミチーガ群では-0.58であった。両群間の差(ミチーガ群−プラセボ群、最小二乗平均値)は−0.36(95% CI:−0.65~−0.08)であり、統計学的に有意な差が認められ、その効果は投与開始15日後まで継続して認められた(投与開始3日後~投与開始15日後の各時点:p<0.05、MMRM※、名目上のp値)。ベースラインから投与開始2週後までの各日のかゆみスコア変化量の経時推移(FAS) 記事/インライン画像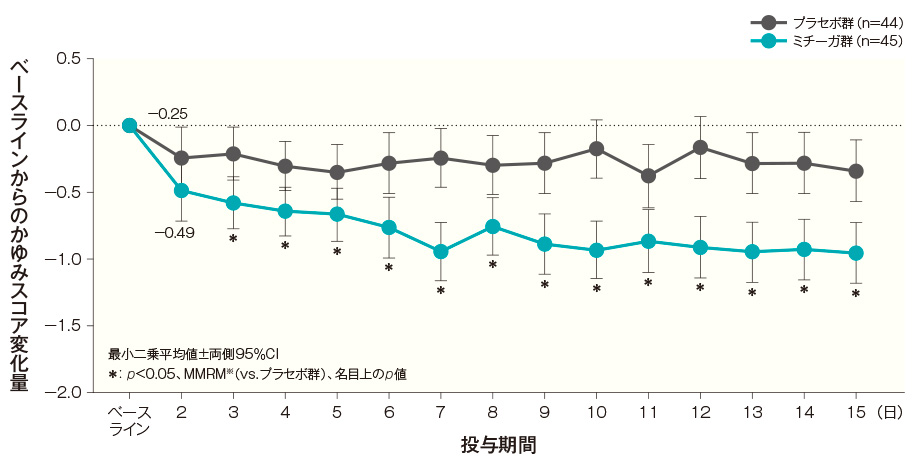 かゆみスコアの詳細はこちら
かゆみスコアの詳細はこちら- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインのかゆみスコアを共変量とした。
- 投与開始16週後のかゆみスコアが1以下になった患者の割合(FAS)(副次評価項目)
-
投与開始16週後のかゆみスコアが1以下になった患者の割合は、プラセボ群では2.3%、ミチーガ群では24.4%であった。両群間の差(ミチーガ群-プラセボ群)は22.2%(95%CI:8.9~35.5%)であり、統計学的に有意な差が認められた(p<0.01、Fisherの正確検定、名目上のp値)。
かゆみスコアの詳細はこちら投与開始16週後のかゆみスコアが1以下になった患者の割合(FAS) 記事/インライン画像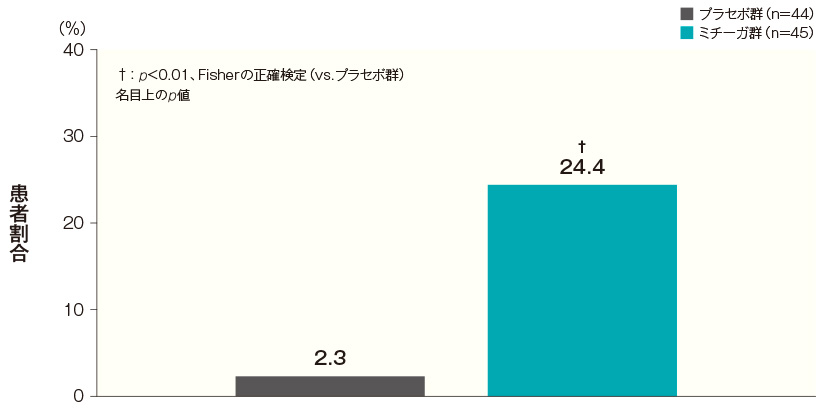
- 投与開始16週後のそう痒NRS変化率(FAS)(副次評価項目)
-
投与開始16週後のベースラインからのそう痒NRS変化率(最小二乗平均値)は、プラセボ群では−17.96%、ミチーガ群では−49.24%であった。両群間の差(ミチーガ群−プラセボ群、最小二乗平均値)は−31.28%(95%CI:−42.76~−19.80%)であり、統計学的に有意な差が認められた(p<0.0001、MMRM※、名目上のp値)。
投与開始16週後のベースラインからのそう痒NRS変化率(FAS) 記事/インライン画像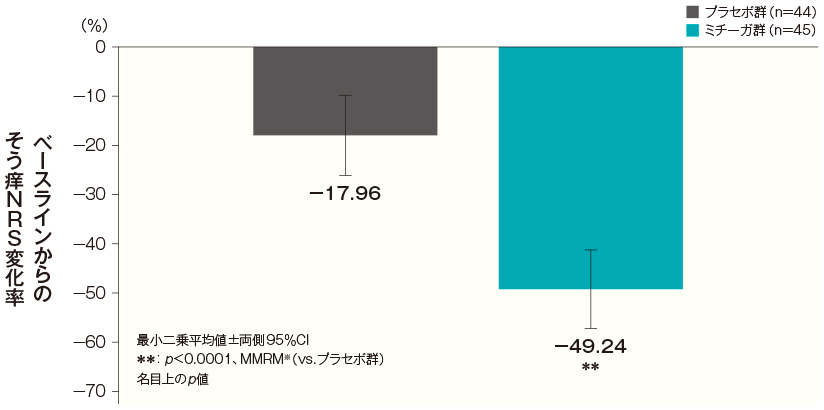 そう痒NRSの詳細はこちら
そう痒NRSの詳細はこちら- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインのそう痒NRSを共変量とした。
- 投与開始16週後のそう痒NRSが4以上改善した患者の割合(FAS)(その他の評価項目)
-
投与開始16週後のそう痒NRSがベースラインから4以上改善した患者の割合は、プラセボ群では6.8%、ミチーガ群では41.9%であった。両群間の差(ミチーガ群−プラセボ群)は35.0%(95%CI:18.5~51.6%)であり、統計学的に有意な差が認められた(p=0.0001、Fisherの正確検定、名目上のp値)。
投与開始16週後のそう痒NRSがベースラインから4以上改善した患者の割合(FAS) 記事/インライン画像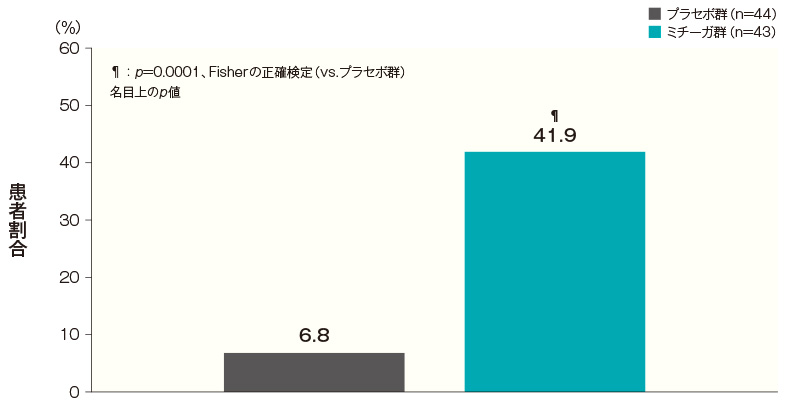 そう痒NRSの詳細はこちら
そう痒NRSの詳細はこちら- ベースラインのそう痒NRSが4以上の患者について解析した。
- 投与開始16週後のそう痒NRS-50達成率及びそう痒NRS-75達成率(FAS)(その他の評価項目)
-
投与開始16週後のそう痒NRS-50達成率は、プラセボ群では15.9%、ミチーガ群では51.1%であった。両群間の差(ミチーガ群−プラセボ群)は35.2%(95%CI:17.0~53.4%)であり、統計学的に有意な差が認められた(p<0.001、Fisherの正確検定、名目上のp値)。
投与開始16週後のそう痒NRS-75達成率は、プラセボ群では0%、ミチーガ群では20.0%であった。両群間の差(ミチーガ群−プラセボ群)は20.0%(95%CI:8.3~31.7%)であり、統計学的に有意な差が認められた(p<0.01、Fisherの正確検定、名目上のp値)。そう痒NRSの詳細はこちら投与開始16週後のそう痒NRS-50達成率及びそう痒NRS-75達成率(FAS) 記事/インライン画像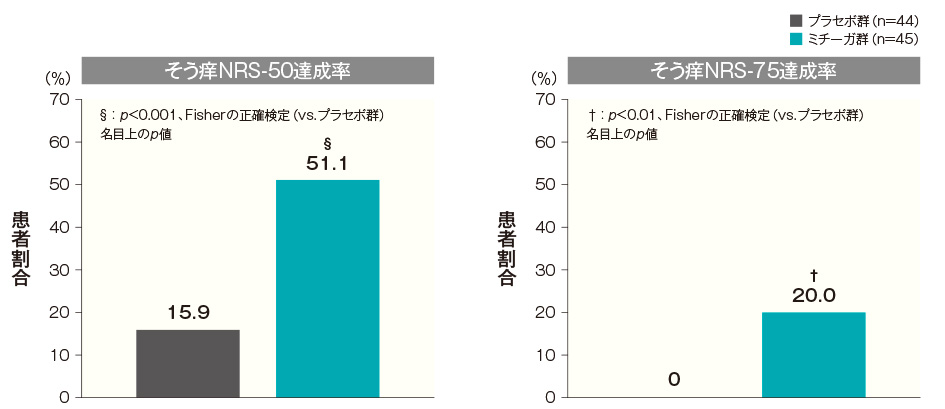
QOL評価(CDLQI、DFI)
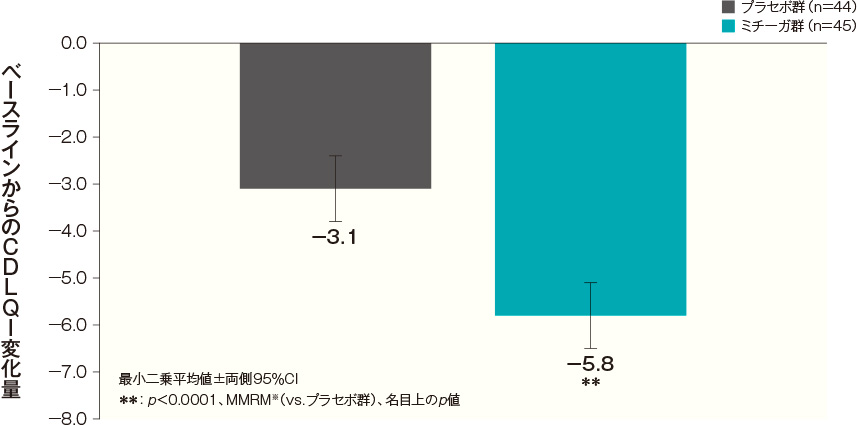
投与開始16週後のCDLQI変化量(FAS)(副次評価項目)
投与開始16週後のベースラインからのCDLQI変化量(最小二乗平均値)は、プラセボ群では-3.1、ミチーガ群では-5.8であった。両群間の差(ミチーガ群-プラセボ群、最小二乗平均値)は-2.7(95%CI:-3.7~-1.7)であり、統計学的に有意な差が認められた(p<0.0001、MMRM※、名目上のp値)。
- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインのCDLQIを共変量とした。
- 投与開始16週後までのCDLQIの経時推移(FAS)(その他の評価項目)
-
CDLQI合計スコアは、ベースラインから投与開始16週後まで以下のとおり推移した。
投与開始16週後までのCDLQI経時推移(FAS) 記事/インライン画像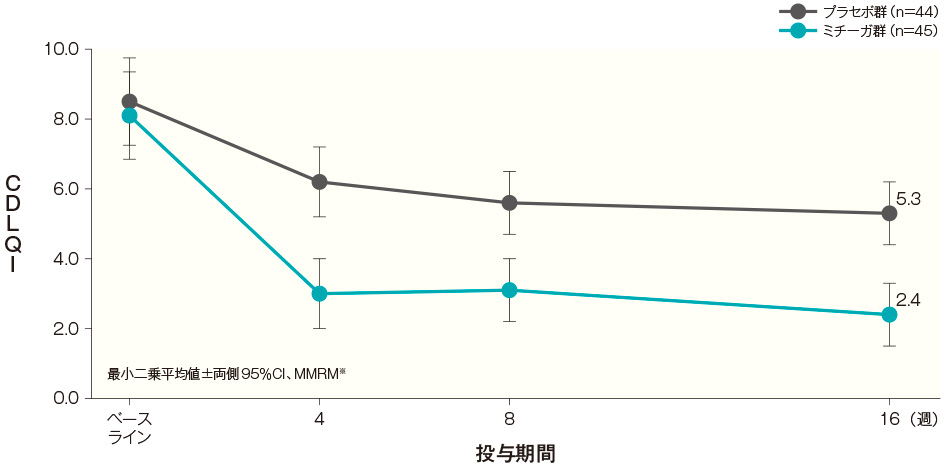 CDLQIの詳細はこちら
CDLQIの詳細はこちら- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインのCDLQIを応答変数とした。
- 投与開始16週後のCDLQI合計スコアが2.5以上改善した患者の割合(FAS)(その他の評価項目)
-
投与開始16週後のCDLQI合計スコアがベースラインから2.5以上改善した患者の割合は、プラセボ群では57.1%、ミチーガ群では83.3%であった。両群間の差(ミチーガ群−プラセボ群)は26.2%(95%CI:7.5~44.9%)であり、統計学的に有意な差が認められた(p<0.05、Fisherの正確検定、名目上のp値)。
投与開始16週後のCDLQI合計スコアが2.5以上改善した患者の割合(FAS) 記事/インライン画像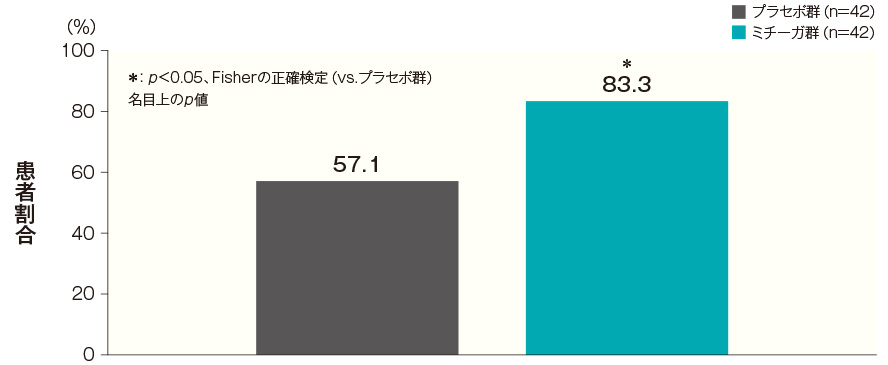 CDLQIの詳細はこちら
CDLQIの詳細はこちら- ベースラインのCDLQI合計スコアが2.5以上の患者について解析した。
- 投与開始16週後のDFIスコア変化量(合計及び項目別)(FAS)(その他の評価項目)
-
投与開始16週後のベースラインからのDFI合計スコア及び項目別スコアの変化量は以下のとおりであった。
DFIの詳細はこちら投与開始16週後のDFIスコア変化量(合計及び項目別)(FAS)
プラセボ群
(n=44*)ミチーガ群
(n=45*)DFI合計スコア −2.8±3.9 −4.4±5.4 DFI項目別スコア 家事 −0.3±1.0 −0.5±0.8 食事の支度や食事を与えること −0.4±1.0 −0.4±0.8 本人以外の家族の睡眠 −0.5±0.8 −0.9±0.9 家族の余暇活動 −0.4±0.7 −0.4±0.8 家族の買い物に費やす時間 0.0±0.5 −0.1±0.6 保護者の出費 −0.2±0.5 −0.2±0.6 保護者の疲労や疲労困憊 −0.2±0.8 −0.7±0.8 保護者の精神的苦痛 −0.3±0.7 −0.5±0.8 主要な保護者と家族との関係 −0.3±0.6 −0.3±0.7 主要な保護者の生活への影響 −0.3±0.8 −0.4±0.7 平均値±標準偏差- *:
- ベースラインでの症例数を示す。投与開始16週後の症例数は、プラセボ群が44例、ミチーガ群が45例であった。
皮膚症状の評価(EASI、POEM)
- 【参考情報】投与開始16週後のEASI変化率(FAS)(副次評価項目)
-
投与開始16週後のベースラインからのEASI変化率(最小二乗平均値)は、プラセボ群では−41.47%、ミチーガ群では−52.41%であった。両群間の差(ミチーガ群−プラセボ群、最小二乗平均値)は−10.94%(95%CI: −28.15~6.28%)であり、有意な差は認められなかった(p=0.2101、MMRM※、名目上のp値)。
ベースラインから投与開始16週後までのEASI変化率の経時推移(FAS)(その他の評価項目) 記事/インライン画像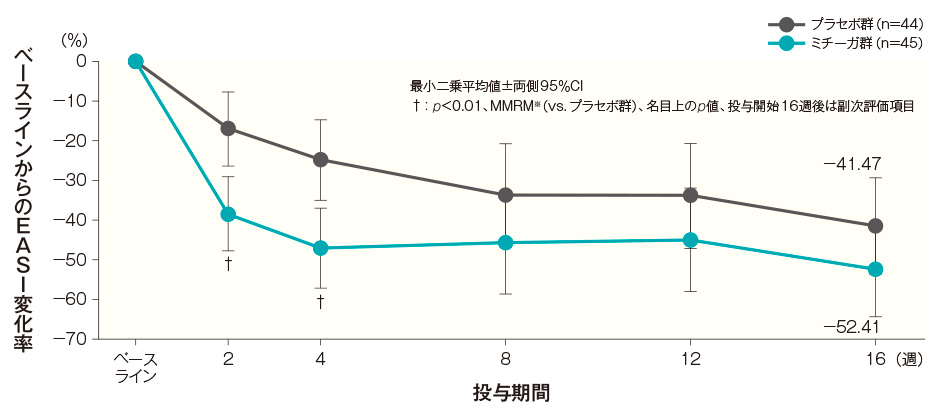 EASIの詳細はこちら
EASIの詳細はこちら- ※:
- 時点、投与群、時点と投与群の交互作用を固定効果、ベースラインのEASIを共変量とした。
- 【参考情報】投与開始16週後のEASI-50達成率及びEASI-75達成率(FAS)(その他の評価項目)
-
投与開始16週後のEASI-50達成率は、プラセボ群では52.3%、ミチーガ群では57.8%であり、有意な差は認められなかった(p=0.6723、Fisherの正確検定、名目上のp値)。
投与開始16週後のEASI-75達成率は、プラセボ群では20.5%、ミチーガ群では31.1%であり、有意な差は認められなかった(p=0.3339、Fisherの正確検定、名目上のp値)。EASIの詳細はこちら投与開始16週後のEASI-50達成率及びEASI-75達成率(FAS) 記事/インライン画像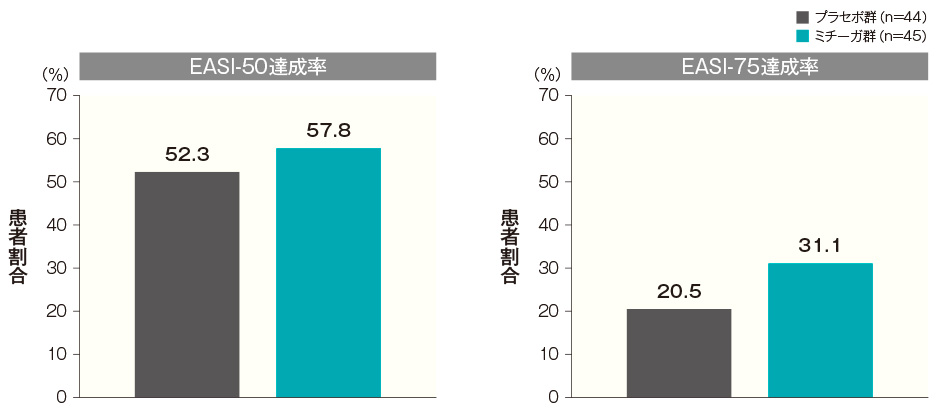
- 【参考情報】投与開始16週後のPOEM合計スコアが4以上改善した患者の割合(FAS)(副次評価項目)
-
投与開始16週後のPOEM合計スコアがベースラインから4以上改善した患者の割合は、プラセボ群では41.9%、ミチーガ群では86.7%であった。両群間の差(ミチーガ群−プラセボ群)は44.8%(95%CI:27.0~62.6%)であり、統計学的に有意な差が認められた(p<0.0001、Fisherの正確検定、名目上のp値)。
投与開始16週後までのPOEM合計スコアがベースラインから4以上改善した患者の割合の経時推移(FAS)(その他の評価項目) 記事/インライン画像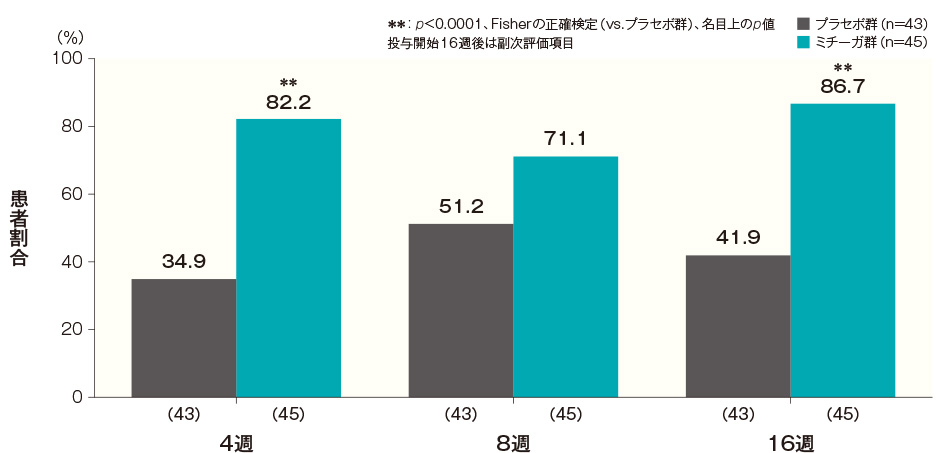 POEMの詳細はこちら
POEMの詳細はこちら- ベースラインのPOEM合計スコアが4以上の患者について解析した。
横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
- ベースラインのPOEM合計スコアが4以上の患者について解析した。
安全性 Part A期間
- 副作用発現状況
-
副作用は、プラセボ群では43例中2例(4.7%)に2件、ミチーガ群では46例中9例(19.6%)に12件認められた。
本試験において、死亡に至った副作用及び重篤な副作用は、プラセボ群及びミチーガ群のいずれにおいても認められなかった。
治療の調整に至った副作用[内訳]は、プラセボ群では認められず、ミチーガ群では1例(2.2%)[休薬:1例(2.2%)に1件(紅斑)、投与中止及び減量:なし]認められた。副作用発現状況(SAF)
プラセボ群
(n=43)ミチーガ群
(n=46)全副作用 2(4.7) 9(19.6) 重篤な副作用 0 0 死亡に至った副作用 0 0 治療の調整に至った副作用 0 1(2.2) 投与中止 0 0 休薬 0 1(2.2) 減量 0 0 注目すべき副作用 注射関連の反応 0 1(2.2) 喘息 0 0 アトピー性皮膚炎の悪化 0 1(2.2) アトピー性皮膚炎の悪化には該当しない浮腫性紅斑
又は鱗屑を伴う皮膚症状0 3(6.5) 皮膚感染症 1(2.3) 2(4.3) 皮膚以外の感染症 0 0 治験薬からの感染病原体感染の疑い 0 0 例数(%)MedDRA/J Version 23.0
主な副作用
主な副作用は、プラセボ群では単純ヘルペス、血中CPK増加、ミチーガ群では紅斑、膿痂疹、アトピー性皮膚炎、下痢、口角口唇炎、肝機能異常などであった。
副作用(SAF)
| プラセボ群 (n=43) |
ミチーガ群 (n=46) |
|
|---|---|---|
| 感染症および寄生虫症 | 1(2.3) | 1(2.2) |
| 膿痂疹 | 0 | 1(2.2) |
| 単純ヘルペス | 1(2.3) | 0 |
| 皮膚および皮下組織障害 | 0 | 4(8.7) |
| アトピー性皮膚炎 | 0 | 1(2.2) |
| 紅斑 | 0 | 3(6.5) |
| 胃腸障害 | 0 | 1(2.2) |
| 下痢 | 0 | 1(2.2) |
| 口角口唇炎 | 0 | 1(2.2) |
| 神経系障害 | 0 | 1(2.2) |
| 頭痛 | 0 | 1(2.2) |
| 肝胆道系障害 | 0 | 1(2.2) |
| 肝機能異常 | 0 | 1(2.2) |
| 臨床検査 | 1(2.3) | 1(2.2) |
| ALT増加 | 0 | 1(2.2) |
| AST増加 | 0 | 1(2.2) |
| 血中CPK増加 | 1(2.3) | 0 |
| γ-GT増加 | 0 | 1(2.2) |
ALT:アラニンアミノトランスフェラーゼ、AST:アスパラギン酸アミノトランスフェラーゼ、CPK:クレアチンホスホキナーゼ、γ-GT:γ-グルタミルトランスフェラーゼ
同一患者で同じ副作用が複数回発現した場合、発現例数は1件としてカウントした。
MedDRA/J Version 23.0
有効性 Part A/B(投与開始68週まで)
かゆみ評価(かゆみスコア、そう痒NRS)
かゆみスコア変化量の経時推移(長期投与期間FAS)(その他の評価項目)
投与開始16週後、32週後、44週後及び68週後のベースラインからのかゆみスコア変化量(平均値)は、プラセボ/ミチーガ群※では−0.54、−1.38、−1.49及び−1.78、ミチーガ群では-1.37、−1.60、−1.70及び−1.80であった。
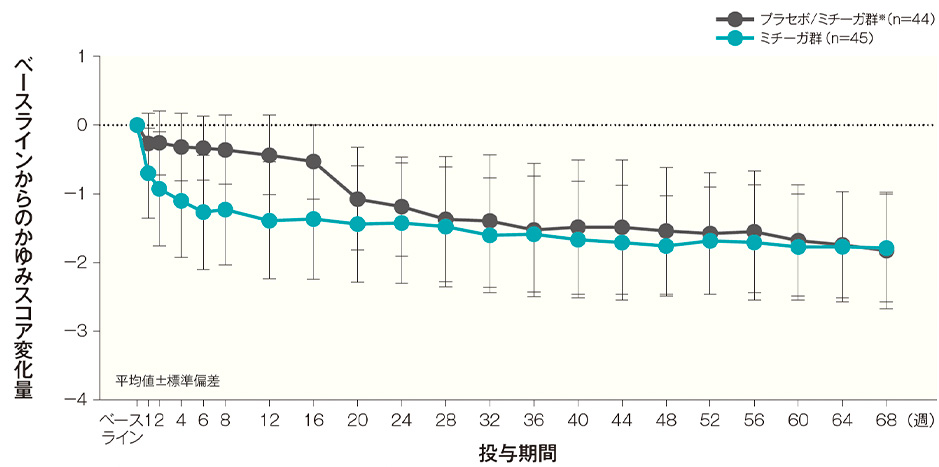
- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を⾏った。
- そう痒NRS変化率の経時推移(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のベースラインからのそう痒NRS変化率(平均値)は、プラセボ/ミチーガ群※では-19.99%、-47.98%、-52.77%及び-60.91%、ミチーガ群では-50.30%、-60.46%、-63.46%及び-65.94%であった。
そう痒NRSの変化率経時推移(長期投与期間FAS) 記事/インライン画像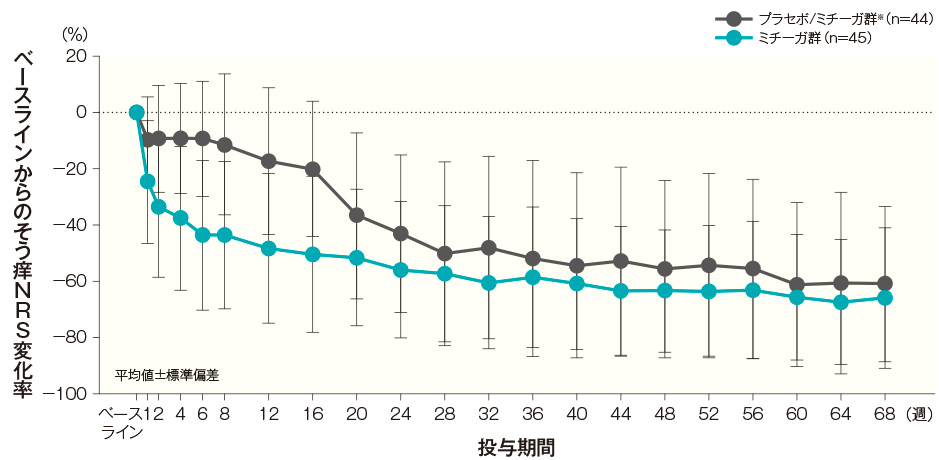 そう痒NRSの詳細はこちら
そう痒NRSの詳細はこちら- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を⾏った。
- そう痒NRSが4以上改善した患者の割合(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のそう痒NRSがベースラインから4以上改善した患者の割合は、プラセボ/ミチーガ群※では6.8%、31.8%、38.6%及び47.7%、ミチーガ群では41.9%、58.1%、58.1%及び55.8%であった(投与開始16週後:p=0.0001、Fisherの正確検定、名目上のp値)。
そう痒NRSがベースラインから4以上改善した患者の割合(長期投与期間FAS) 記事/インライン画像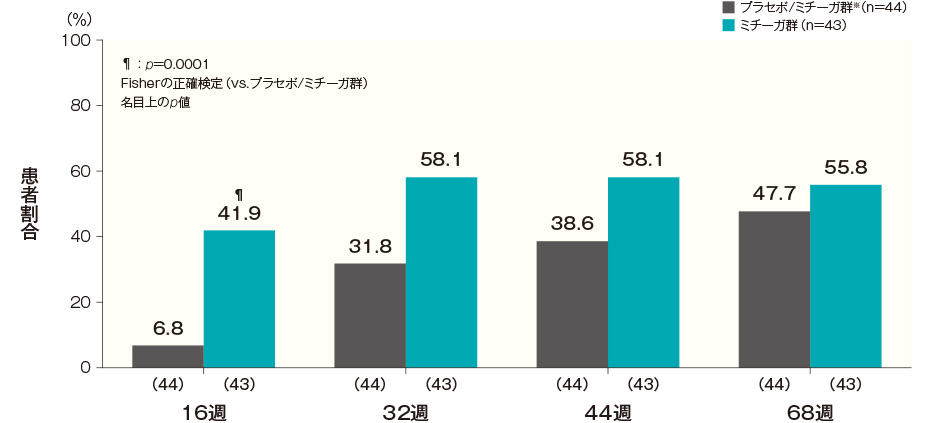 そう痒NRSの詳細はこちら
そう痒NRSの詳細はこちら- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を⾏った。
- ベースラインのそう痒NRSが4以上の患者について解析した。
横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
- そう痒NRS-50達成率及びそう痒NRS-75達成率(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のそう痒NRS-50達成率は、プラセボ/ミチーガ群※では15.9%、38.6%、50.0%及び56.8%、ミチーガ群では51.1%、68.9%、71.1%及び66.7%であった(投与開始16週後:p<0.001、Fisherの正確検定、名目上のp値)。
投与開始16週後、32週後、44週後及び68週後のそう痒NRS-75達成率は、プラセボ/ミチーガ群※では0%、25.0%、25.0%及び29.5%、ミチーガ群では20.0%、24.4%、33.3%及び44.4%であった(投与開始16週後:p<0.01、Fisherの正確検定、名目上のp値)。そう痒NRS-50達成率及びそう痒NRS-75達成率(長期投与期間FAS) 記事/インライン画像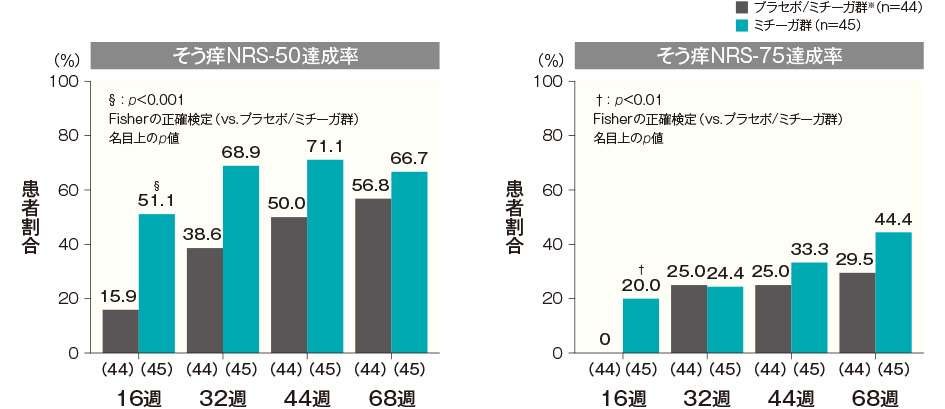 そう痒NRSの詳細はこちら
そう痒NRSの詳細はこちら- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を⾏った。
- 横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
QOL評価(CDLQI、DFI)
CDLQIスコア(合計及び項目別)(長期投与期間FAS)(その他の評価項目)
ベースラインと投与開始68週後のCDLQI合計スコア及び項目別スコアは以下のとおりであった。
CDLQIスコア(合計及び項目別)(長期投与期間FAS)
| プラセボ/ミチーガ群※(n=44*) | ミチーガ群(n=45*) | |||
|---|---|---|---|---|
| 評価時点 | ベースライン | 投与開始68週後 | ベースライン | 投与開始68週後 |
| CDLQI合計スコア | 8.5±4.2 | 1.8±1.3 | 8.1±4.3 | 1.7±1.9 |
| CDLQI項目別スコア | ||||
| 症状・感情 | 3.0±1.3 | 0.7±0.6 | 2.8±1.3 | 0.8±0.8 |
| 日常生活 | 1.6±1.3 | 0.2±0.6 | 1.6±1.6 | 0.2±0.6 |
| 学校・休暇 | 0.8±0.8 | 0.1±0.5 | 0.9±0.9 | 0.1±0.3 |
| 人間関係 | 0.5±1.0 | 0.0±0.2 | 0.4±0.8 | 0.0±0.2 |
| 睡眠 | 1.4±0.9 | 0.2±0.4 | 1.2±0.8 | 0.1±0.3 |
| 治療 | 1.2±1.1 | 0.6±0.8 | 1.3±0.9 | 0.5±0.7 |
- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を行った。
- *:
- ベースラインでの症例数を示す。投与開始68週後の症例数は、プラセボ/ミチーガ群が39例、ミチーガ群が43例であった。
- CDLQI合計スコアが2.5以上改善した患者の割合(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のCDLQI合計スコアがベースラインから2.5以上改善した患者の割合は、プラセボ/ミチーガ群※では57.1%、78.6%、81.0%及び83.3%、ミチーガ群では83.3%、76.2%、81.0%及び85.7%であった。
CDLQI合計スコアが2.5以上改善した患者の割合(長期投与期間FAS) 記事/インライン画像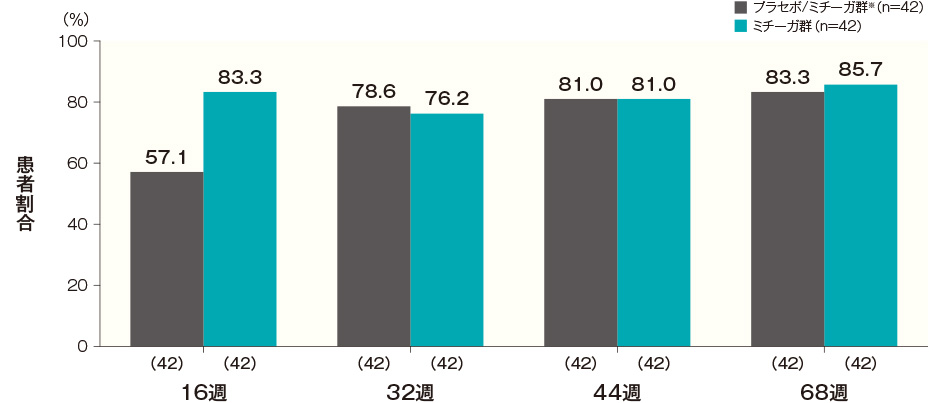 CDLQIの詳細はこちら
CDLQIの詳細はこちら- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を⾏った。
- ベースラインのCDLQI合計スコアが2.5以上の患者について解析した。なお、CDLQIの臨床的に有意な最小変化量はCDLQI合計スコアが2.5以上改善することとされている。
横軸上のカッコ内の数値は各評価時点で解析した症例数を示す。
DFIスコア変化量(その他の評価項目)
ベースラインから投与開始68週後まで、DFI合計スコア変化量はA)のとおり推移した。投与開始68週後のベースラインからのDFI合計スコア及び項目別スコアの変化量はB)のとおりであった。
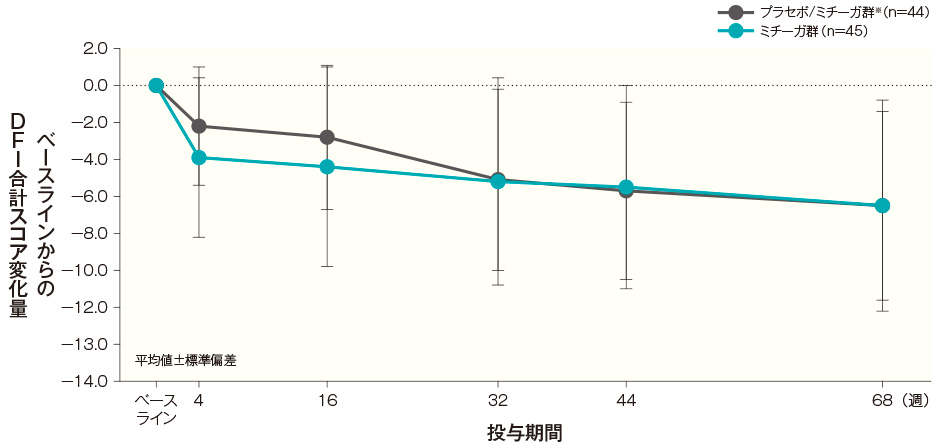
B)投与開始68週後のベースラインからのDFI合計スコア及び項目別スコアの変化量(長期投与期間FAS)
| プラセボ/ミチーガ群※(n=44*) | ミチーガ群(n=45*) | |
|---|---|---|
| DFI合計スコア | −6.5±5.1 | −6.5±5.7 |
| DFI項目別スコア | ||
| 家事 | −1.0±1.0 | −0.7±0.8 |
| 食事の支度や食事を与えること | −0.9±0.9 | −0.6±0.9 |
| 本人以外の家族の睡眠 | −1.0±0.9 | −1.2±0.9 |
| 家族の余暇活動 | −0.5±0.6 | −0.6±0.8 |
| 家族の買い物に費やす時間 | −0.2±0.5 | −0.3±0.6 |
| 保護者の出費 | −0.4±0.6 | −0.4±0.7 |
| 保護者の疲労や疲労困憊 | −0.7±0.8 | −1.0±0.8 |
| 保護者の精神的苦痛 | −0.6±0.8 | −0.7±0.9 |
| 主要な保護者と家族との関係 | −0.6±0.8 | −0.5±0.8 |
| 主要な保護者の生活への影響 | −0.6±1.0 | −0.7±0.8 |
- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を行った。
- *:
- ベースラインでの症例数を示す。投与開始68週後の症例数は、プラセボ/ミチーガ群が39例、ミチーガ群が43例であった。
皮膚症状の評価(EASI、POEM、痒疹数)
- 【参考情報】EASI変化率の経時推移(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のベースラインからのEASI変化率(平均値)は、プラセボ/ミチーガ群※では−41.08%、−67.99%、−75.43%及び−79.48%、ミチーガ群では−52.81%、−61.84%、−68.30%及び−77.06%であった。
EASI変化率の経時推移(長期投与期間FAS) 記事/インライン画像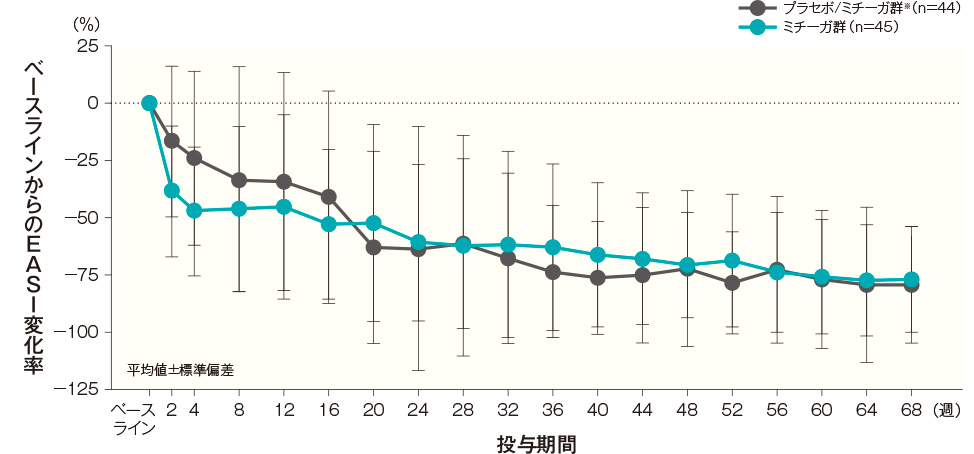 EASIの詳細はこちら
EASIの詳細はこちら- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を⾏った。
- 【参考情報】POEM合計スコアの経時推移(長期投与期間FAS)(その他の評価項目)
-
投与開始16週後、32週後、44週後及び68週後のPOEM合計スコア(平均値)は、プラセボ/ミチーガ群※では14.3、7.5、5.6及び6.2、ミチーガ群では7.2、7.2、6.1及び5.0であった。
POEM合計スコアの経時推移(長期投与期間FAS) 記事/インライン画像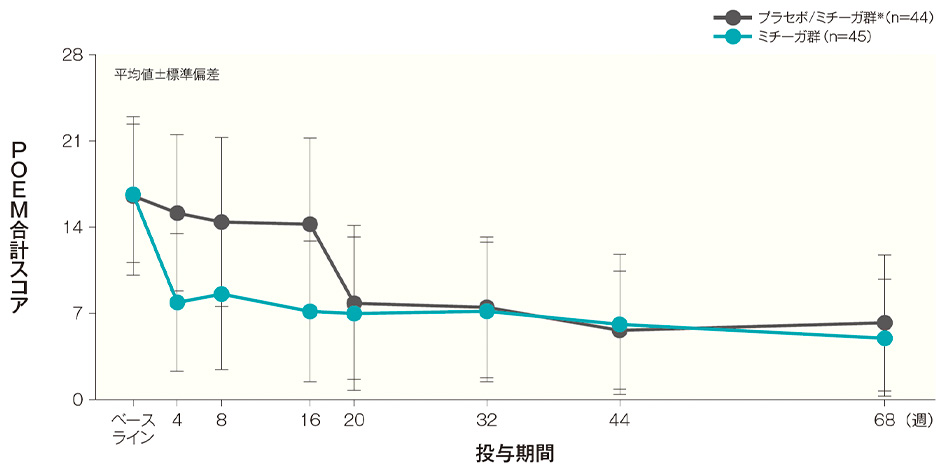 POEMの詳細はこちら
POEMの詳細はこちら- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を⾏った。
- 【参考情報】痒疹数の経時推移(長期投与期間FAS)(その他の評価項目)
-
ベースラインから投与開始68週後までの痒疹数は以下のとおりであった。
痒疹数の経時推移(長期投与期間FAS)
プラセボ/ミチーガ群※(n=44*) ミチーガ群(n=45*) 痒疹数(個) 0 1~9 10~19 20~49 50~99 100~ 0 1~9 10~19 20~49 50~99 100~ 評価時点 ベース
ライン9
(20.5)14
(31.8)2
(4.5)9
(20.5)7
(15.9)3
(6.8)11
(24.4)11
(24.4)7
(15.6)9
(20.0)5
(11.1)2
(4.4)投与開始
16週後17
(38.6)7
(15.9)7
(15.9)7
(15.9)6
(13.6)0 21
(46.7)7
(15.6)7
(15.6)5
(11.1)4
(8.9)1
(2.2)投与開始
44週後25
(59.5)15
(35.7)1
(2.4)0 0 1
(2.4)29
(65.9)6
(13.6)4
(9.1)3
(6.8)0 2
(4.5)投与開始
68週後30
(75.0)9
(22.5)0 0 1
(2.5)0 30
(69.8)9
(20.9)3
(7.0)0 0 1
(2.3)例数(%)
- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を行った。
- *:
- ベースラインでの症例数を示す。投与開始16週後、44週後、68週後の症例数は、プラセボ/ミチーガ群がそれぞれ44例、42例、40例、ミチーガ群がそれぞれ45例、44例、43例であった。
安全性 Part A/B期間全体
- 副作用発現状況
-
副作用は、プラセボ/ミチーガ群※では43例中12例(27.9%)に23件、ミチーガ群では46例中14例(30.4%)に21件認められた。
本試験において、死亡に至った副作用は認められなかった。
重篤な副作用は、ミチーガ群では1例(2.2%)に1件(膿痂疹)認められ、プラセボ/ミチーガ群※では認められなかった。
治療の調整に至った副作用[内訳]は、プラセボ/ミチーガ群※では2例(4.7%)[投与中止:1例(2.3%) に1件(紅斑)、休薬:1例(2.3%)に1件(発疹)、減量:なし]、ミチーガ群では1例(2.2%)[休薬:1例(2.2%)に1件(紅斑)、投与中止及び減量:なし]に認められた。副作用発現状況(長期投与期間SAF)
プラセボ/ミチーガ群※
(n=43)ミチーガ群
(n=46)全副作用 12(27.9) 14(30.4) 重篤な副作用 0 1(2.2) 死亡に至った副作用 0 0 治療の調整に至った副作用 2(4.7) 1(2.2) 投与中止 1(2.3) 0 休薬 1(2.3) 1(2.2) 減量 0 0 注目すべき副作用 注射関連の反応 3(7.0) 1(2.2) 喘息 0 0 アトピー性皮膚炎の悪化 1(2.3) 1(2.2) アトピー性皮膚炎の悪化には該当しない浮腫性紅斑
又は鱗屑を伴う皮膚症状5(11.6) 4(8.7) 皮膚感染症 3(7.0) 3(6.5) 皮膚以外の感染症 1(2.3) 0 治験薬からの感染病原体感染の疑い 0 0 例数(%)- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を⾏った。
MedDRA/J Version 23.0
主な副作用
主な副作用は、プラセボ/ミチーガ群※では紅斑、貨幣状湿疹など、ミチーガ群では紅斑、ケモカイン増加などであった。
副作用(長期投与期間SAF)
| プラセボ/ミチーガ群※ (n=43) |
ミチーガ群 (n=46) |
|
|---|---|---|
| 皮膚および皮下組織障害 | 8(18.6) | 6(13.0) |
| 紅斑 | 4(9.3) | 3(6.5) |
| アトピー性皮膚炎 | 1(2.3) | 1(2.2) |
| 丘疹性皮疹 | 0 | 1(2.2) |
| 酒さ | 0 | 1(2.2) |
| 蕁麻疹 | 0 | 1(2.2) |
| 貨幣状湿疹 | 2(4.7) | 0 |
| 湿疹 | 1(2.3) | 0 |
| 丘疹 | 1(2.3) | 0 |
| 発疹 | 1(2.3) | 0 |
| 臨床検査 | 2(4.7) | 3(6.5) |
| ケモカイン増加 | 1(2.3) | 2(4.3) |
| ALT増加 | 0 | 1(2.2) |
| AST増加 | 0 | 1(2.2) |
| γ-GT増加 | 0 | 1(2.2) |
| 血中CPK増加 | 1(2.3) | 0 |
| 感染症および寄生虫症 | 4(9.3) | 2(4.3) |
| 膿痂疹 | 1(2.3) | 1(2.2) |
| 伝染性軟属腫 | 0 | 1(2.2) |
| 単純ヘルペス | 1(2.3) | 0 |
| 帯状疱疹 | 1(2.3) | 0 |
| 耳下腺炎 | 1(2.3) | 0 |
| 眼障害 | 0 | 1(2.2) |
| 眼瞼浮腫 | 0 | 1(2.2) |
| 胃腸障害 | 0 | 1(2.2) |
| 口角口唇炎 | 0 | 1(2.2) |
| 下痢 | 0 | 1(2.2) |
| 肝胆道系障害 | 0 | 1(2.2) |
| 肝機能異常 | 0 | 1(2.2) |
| 神経系障害 | 0 | 1(2.2) |
| 頭痛 | 0 | 1(2.2) |
| 一般・全身障害および投与部位の状態 | 1(2.3) | 0 |
| 注射部位紅斑 | 1(2.3) | 0 |
| 注射部位そう痒感 | 1(2.3) | 0 |
| 注射部位反応 | 1(2.3) | 0 |
同一患者で同じ副作用が複数回発現した場合、発現例数は1件としてカウントした。
- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を⾏った。
MedDRA/J Version 23.0
- 臨床検査(アトピー性皮膚炎バイオマーカー:TARC)
-
TARC値
ミチーガ群では、投与開始4週後から12週後にかけて血清TARC値が上昇し、その後は経時的に低下し、投与開始68週後は投与開始前と同程度の値となった。
プラセボ/ミチーガ群※では、投与開始16週後にミチーガの投与を開始すると、投与開始20週後(ミチーガ投与開始4週後)から24週後(ミチーガ投与開始8週後)にかけて血清TARC値が上昇し、その後は経時的に低下した。血清TARC値(中央値)の経時推移(長期投与期間SAF) 記事/インライン画像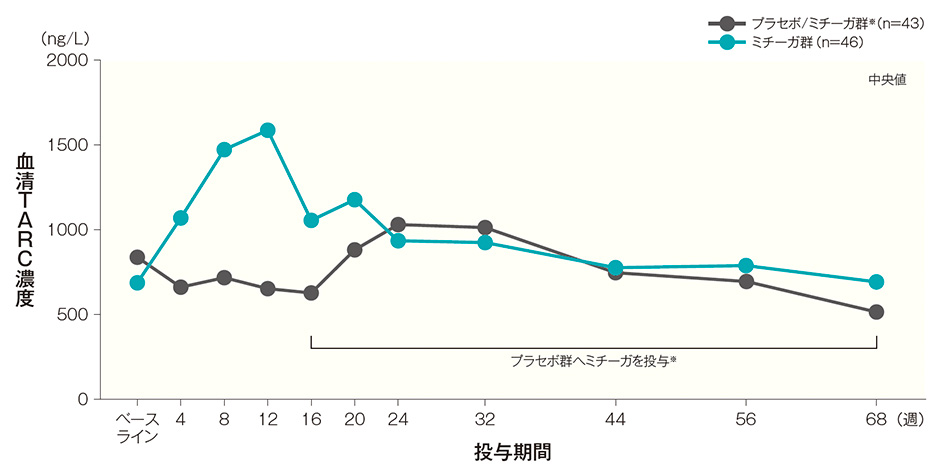
- ※:
- プラセボ/ミチーガ群は16週までプラセボを、それ以降はミチーガの投与を行った。
- TARC値とEASI及びかゆみスコアの相関性
-
血清TARC値は、アトピー性皮膚炎の短期病勢のマーカーとして用いられていることから、ミチーガ投与後にみられた血清TARC値の上昇に伴って病状が変化しているかを確認するため、投与開始4週後及び8週後の血清TARC値の変化率とEASI変化率及びかゆみスコア変化量の相関性を検討した。
ミチーガ群及びプラセボ群ともに、血清TARC値の変化率とEASI変化率の間、及び血清TARC値の変化率とかゆみスコア変化量の間に相関性はみられなかった。血清TARC値とEASIの相関性(SAF) <投与開始4週後>
記事/インライン画像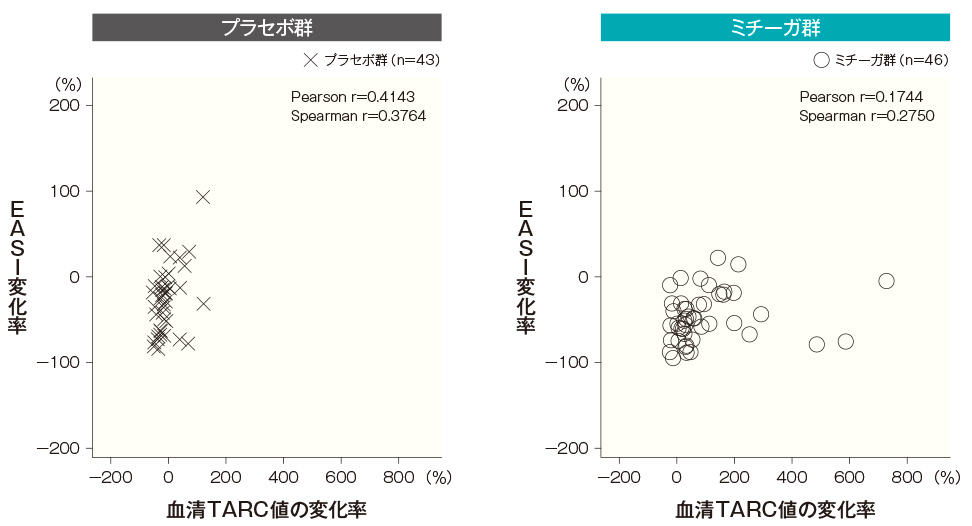
<投与開始8週後>
記事/インライン画像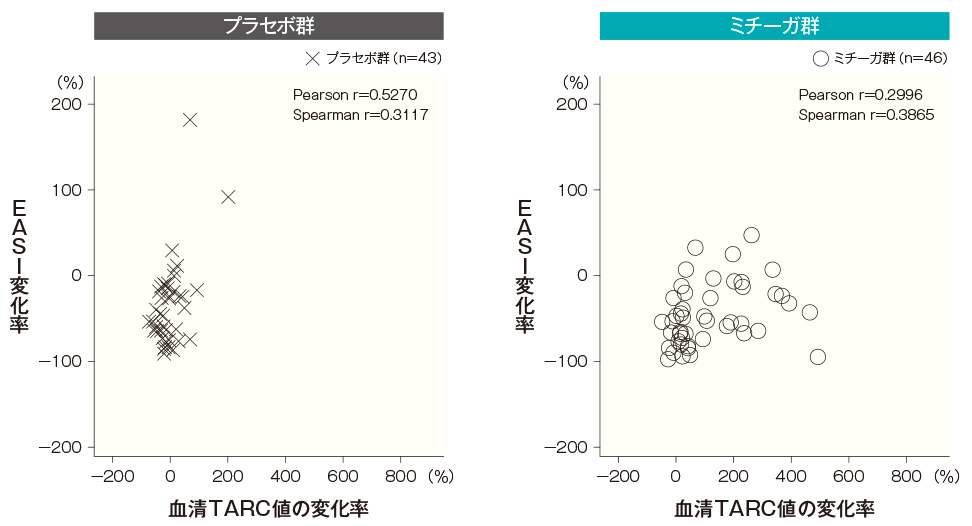
血清TARC値とかゆみスコアの相関性(SAF) <投与開始4週後>
記事/インライン画像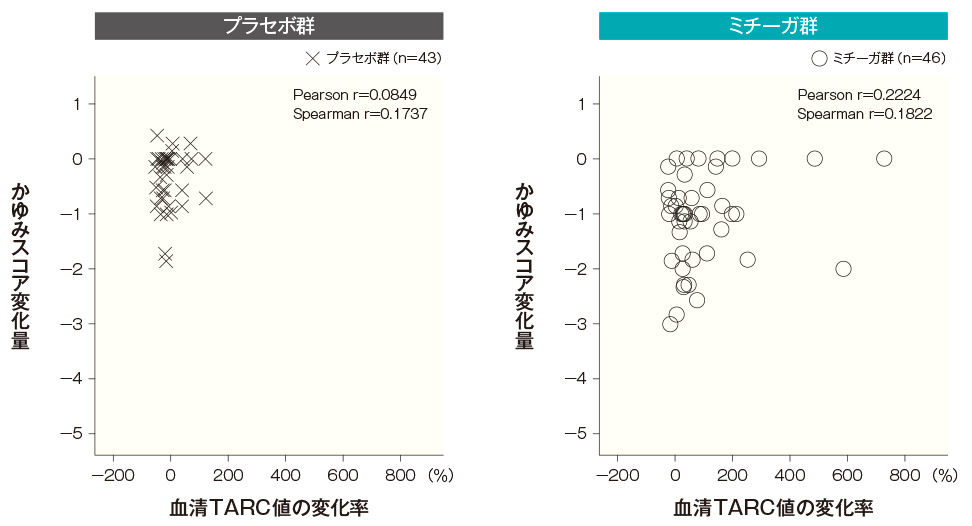
<投与開始8週後>
記事/インライン画像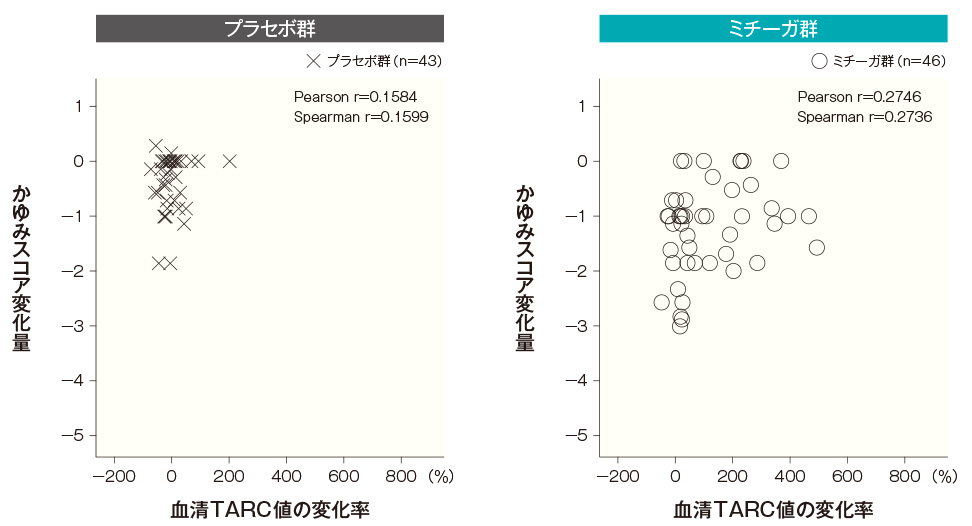
- 5. 効能・効果に関連する注意(抜粋)
〈アトピー性皮膚炎に伴うそう痒〉 -
- 5.1
- ステロイド外用剤やタクロリムス外用剤等の抗炎症外用剤及び抗ヒスタミン剤等の抗アレルギー剤による適切な治療を一定期間施行しても、そう痒を十分にコントロールできない患者に投与すること。[17.1.1参照]
- 5.2
- 本剤はそう痒を治療する薬剤であり、そう痒が改善した場合も含め、本剤投与中はアトピー性皮膚炎に対して必要な治療を継続すること。[8.2参照]
- 5.3
- 原則として、本剤投与時にはアトピー性皮膚炎の病変部位の状態に応じて抗炎症外用剤を併用すること。[8.2参照]
- 5.4
- 本剤投与時も保湿外用剤を継続使用すること。[8.2参照]
- 6. 用法・用量(抜粋)
〈アトピー性皮膚炎に伴うそう痒〉 -
- 通常、6歳以上13歳未満の小児にはネモリズマブ(遺伝子組換え)として1回30mgを4週間の間隔で皮下投与する。
- 7. 用法・用量に関連する注意
-
- 7.1
- 本剤投与後に浮腫性紅斑、湿疹等の発現を含む、皮膚症状の悪化が認められているので、皮膚症状が悪化した場合には、本剤の継続の可否について慎重に検討すること。
- 7.2
- 本剤とミチーガ皮下注用60mgシリンジの生物学的同等性は示されていないことから、互換使用を行わないこと。
- 8. 重要な基本的注意
〈効能共通〉 -
- 8.1
- 本剤投与中の患者に生ワクチンを接種する場合は、患者の状態を慎重に確認し、十分な注意を払うこと。
- 〈アトピー性皮膚炎に伴うそう痒〉
- 8.2
- 以下の点について患者に説明し、理解したことを確認したうえで投与すること。[5.2-5.4参照]
- ・本剤はそう痒を治療する薬剤であることから、アトピー性皮膚炎に対する治療を継続すること。
- ・そう痒が改善した場合もアトピー性皮膚炎に対する治療を怠らないこと。
- 12. 臨床検査結果に及ぼす影響
〈アトピー性皮膚炎に伴うそう痒〉 -
- 12.1
- 本剤の投与により、アトピー性皮膚炎の炎症症状とは一致しない一過性の血清TARC値の上昇が認められている。本剤投与開始から一定期間は血清TARC値をアトピー性皮膚炎の短期病勢マーカーとして使用できないことに留意すること。



