アトピー性皮膚炎患者(13歳以上)を対象とした長期投与試験
長期投与試験(M525101-02)
(1)試験概要
- 主要目的
- 既存治療を実施したにもかかわらず中等度以上のそう痒を有するアトピー性皮膚炎患者を対象に、ミチーガを4週間に1回(Q4W)、長期間皮下投与(52週間)した際の安全性を評価する。
- 副次的目的
- 長期皮下投与した際の有効性、自己注射における安全性及び有効性を評価する。
- 対象
- 既存治療を実施したにもかかわらず中等度以上のそう痒を有する13歳以上のアトピー性皮膚炎患者
- 選択基準
-
- 同意取得日の年齢が13歳以上のアトピー性皮膚炎と診断された患者
- 同意取得時点での外用治療:strongクラス以上のステロイド外用薬又はタクロリムス軟膏を固定の用法で4週間以上継続投与したが、そう痒が残存していた(かゆみスコア≧3)患者、又はステロイド外用薬又はタクロリムス軟膏による外用治療を実施することができない患者(過敏症・禁忌等)
- 同意取得時点での抗ヒスタミン薬及び抗アレルギー薬による内服治療:抗ヒスタミン薬又は抗アレルギー薬を固定の用法・用量で2週間以上継続投与したが、効果不十分(かゆみスコア≧3)と判定された患者、又は抗ヒスタミン薬又は抗アレルギー薬による内服治療を実施することができない患者(過敏症・禁忌等)
- スクリーニング検査日のそう痒VAS≧50mmかつかゆみスコア≧3
- 治療開始日2日前から治療開始日の全3日間のそう痒VAS≧50mm及びかゆみスコア≧2、かつ3日間のうち2日のかゆみスコア≧3 等
- 除外基準
-
- 悪性腫瘍の既往を有する又は合併
- 治療開始日の体重が30.0kg未満
- 治療開始日前の28日以内に全身性のステロイド、免疫抑制剤、光線療法、減感作療法、又は変調療法を実施
- 治療開始日前28日以内に生ワクチンを接種した又は治療期間中(ランダム化日から52週後来院日まで)に生ワクチンの接種予定がある患者 等
- 症例数
- 88例(医療従事者による投与群:44例、自己注射群:44例)
- 投与方法
- 治療期間:52週間
- ミチーガ60mgを4週間隔で48週後まで投与した。
- 治療開始日、4週後及び8週後来院日は医師が投与し、12週後来院日は医療従事者による投与(医療従事者による投与群)又は自己注射(自己注射群)とした。
- 医療従事者による投与群:医師、又は医師の指示の下での投与可能な有資格者が、ミチーガ1本を患者の上腕部、腹部又は大腿部のうち病変のない皮膚にゆっくりと皮下投与した。
- 自己注射群:医師の指導の下、又は医療機関外(自宅等)で、患者がミチーガ1本を自身の腹部又は大腿部のうち病変のない皮膚にゆっくりと皮下投与した。
- 評価項目
-
<有効性>
そう痒VAS、EASI、ISI 等
<安全性>
有害事象、臨床検査、バイタルサイン、12誘導心電図
- 解析計画
-
- 解析計画
-
<有効性>
- 連続データ(そう痒VAS、EASI)は生値、ベースラインからの変化量及び変化率それぞれの要約統計量、その他の連続データ(そう痒NRS、ISI)は生値の要約統計量を算出した。また、そう痒VAS及びEASIの生値、変化量及び変化率は、平均値及び標準偏差を用いて経時推移図を作成した。
- ISIは合計スコア7以下の基準まで改善した患者の例数及び割合を投与群及び時点毎に求めた。連続データ及びカテゴリカルデータを要約する際には、欠測データは補完しなかった。二値データを要約する際には、欠測データはNon-responderとして取り扱った。
<安全性>
有害事象はMedDRA/J Version 20.1を用いて読み替えた。フォローアップ期間に発現した有害事象も集計に含めた。重要な有害事象は、治験薬の投与中止に至った有害事象(休薬・減量を含む)及び注目すべき有害事象とした。注目すべき有害事象は、治験薬投与後に発現した a)注射関連の反応(注射部位の局所反応及び全身性の注射反応を含む)、b)喘息、c)アトピー性皮膚炎の悪化、d)皮膚感染症、e)皮膚以外の感染症、f)CPK上昇(基準値上限の2.5倍以上)、g)治験薬からの感染病原体感染の疑い、と定義した。
(2)試験デザイン
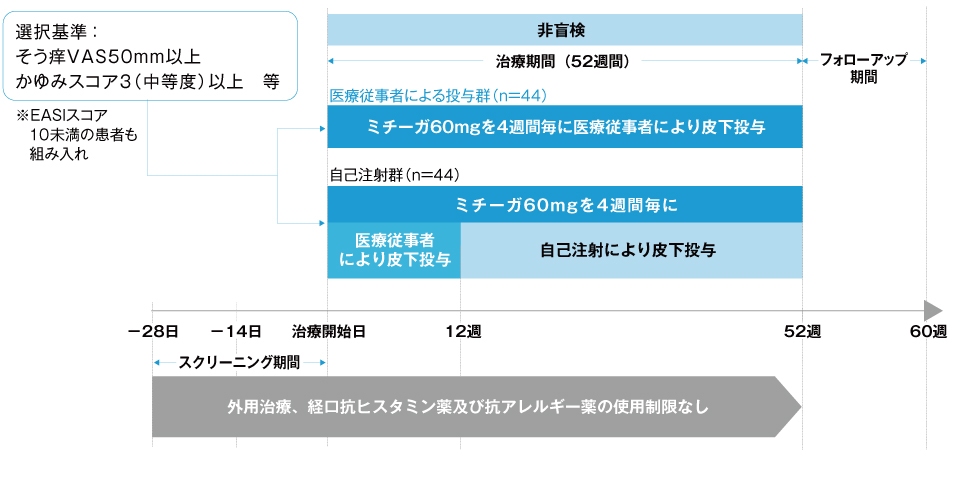
(3)患者背景
人口統計学的及び他の基準値の特性(SAF)
| 医療従事者による 投与群 (n=44) |
自己注射群 (n=44) |
全体 (n=88) |
|
|---|---|---|---|
| 性別:男性、例数(%) 女性、例数(%) |
24(54.5) 20(45.5) |
32(72.7) 12(27.3) |
56(63.6) 32(36.4) |
| 年齢中央値、歳(範囲) | 40.0(13-59) | 39.5(17-70) | 40.0(13-70) |
| Strong、Very Strong、 Strongest クラス ステロイド外用薬ありd)、 例数(%) |
44(100) | 43(97.7) | 87(98.9) |
| カルシニューリン阻害外用薬ありd)、 例数(%) |
26(59.1) | 17(38.6) | 43(48.9) |
| 経口抗ヒスタミン薬又は 抗アレルギー薬ありd)、 例数(%) |
42(95.5) | 40(90.9) | 82(93.2) |
| 罹病期間中央値、年(範囲) | 30.49(6.5-53.6)a) | 31.56(7.5-45.4)b) | 31.03(6.5-53.6)c) |
| アレルギー疾患合併e)のある患者、 例数(%) |
24(54.5) | 28(63.6) | 52(59.1) |
| 投与部位(初回投与) 上腕部 腹部 大腿部 |
26(59.1) 13(29.5) 5(11.4) |
8(18.2) 23(52.3) 13(29.5) |
34(38.6) 36(40.9) 18(20.5) |
| そう痒VASスコア中央値(範囲) | 78.11(56.1-95.3) | 79.57(54.4-96.3) | 78.92(54.4-96.3) |
| かゆみスコア中央値(範囲) | 3.00(2.3-4.0) | 3.00(2.6-4.0) | 3.00(2.3-4.0) |
| EASIスコア中央値(範囲) | 28.050(6.70-60.55) | 26.350(6.30-72.00) | 26.975(6.30-72.00) |
a)n=39
b)n=37
c)n=76
d)初回投与前28日間に投与
e)季節性アレルギー、アレルギー性鼻炎、アレルギー性結膜炎、食物アレルギー、喘息(インフォームドコンセント時)
有効性
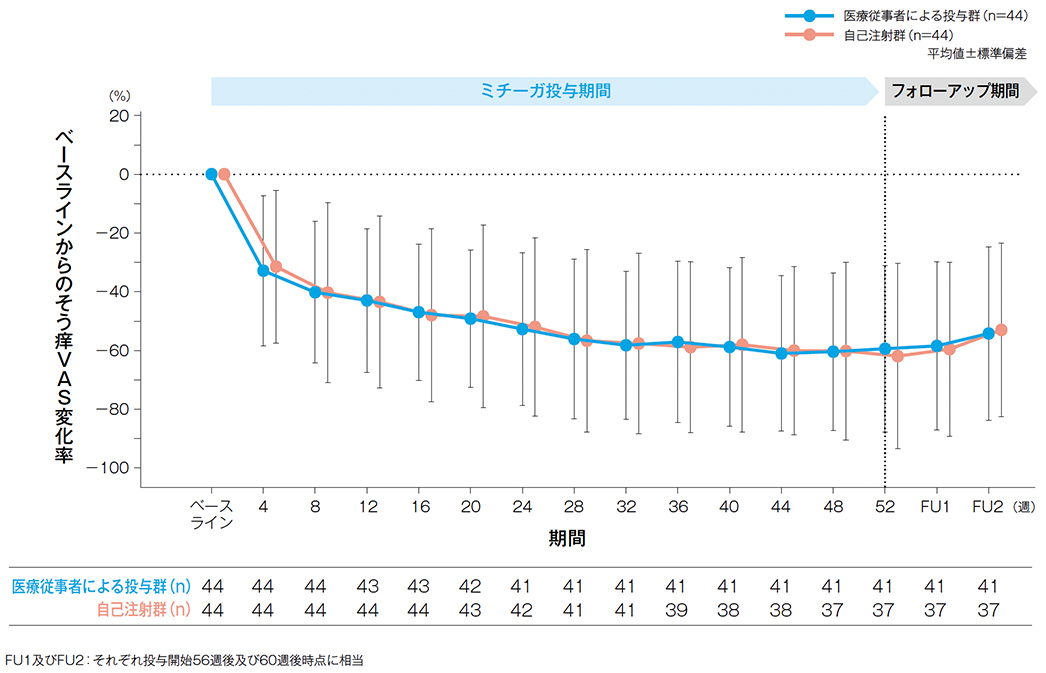
かゆみ評価(そう痒VAS)
そう痒VAS変化率の経時推移(有効性評価項目)
投与開始4週後、16週後、28週後、44週後、52週後及びFU2*のベースラインからのそう痒VAS変化率(平均値)は、医療従事者による投与群では、-32.86%、-46.97%、-56.11%、-61.03%、-59.42%、-54.24%、自己注射群**では、-31.49%、-47.99%、-56.69%、-60.06%、-61.94%、-53.01%であった。
*FU2:投与開始60週後時点に相当
**投与8週後までは医療従事者が投与
そう痒VASの詳細はこちら
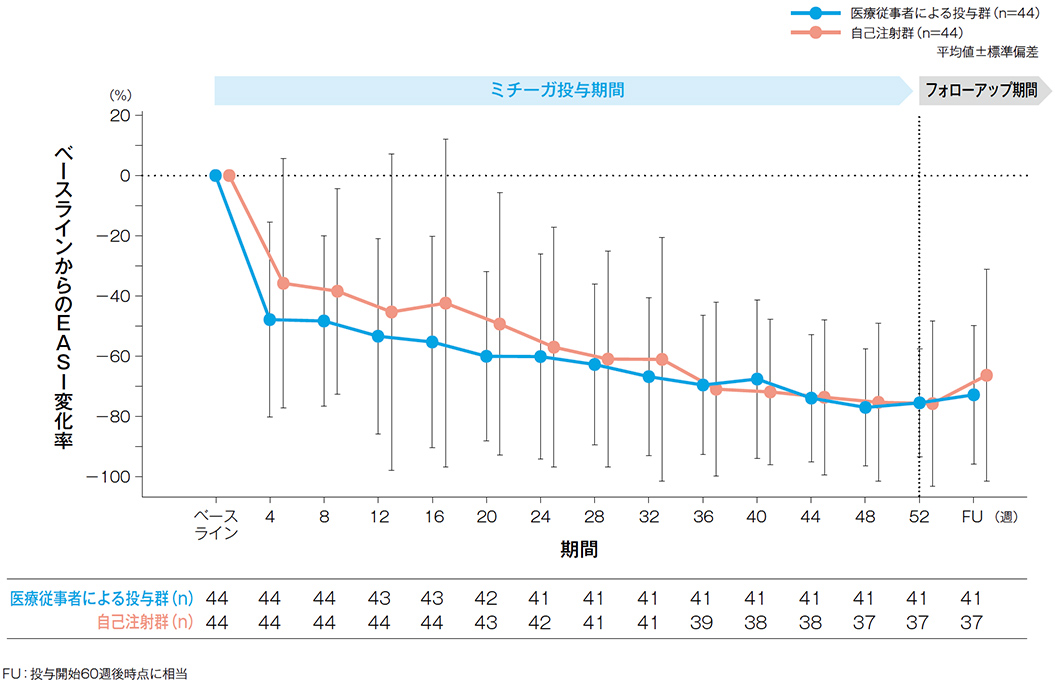
EASI
EASI変化率の経時推移(有効性評価項目)
投与開始4週後、16週後、28週後、44週後、52週後及びFU*のベースラインからのEASI変化率(平均値)は、医療従事者による投与群では、-47.81%、-55.23%、-62.70%、-73.86%、-75.42%、-72.76%、自己注射群**では、-35.76%、-42.34%、-60.91%、-73.58%、-75.68%、-66.28%であった。
*FU:投与開始60週後時点に相当
**投与8週後までは医療従事者が投与
EASIの詳細はこちら
- 【参考情報】ISIの経時推移
-
ベースラインのISIスコア(平均値)は11.4であり、投与開始4週後、16週後、28週後、40週後及び52週後はそれぞれ7.6、6.8、6.2、6.8及び7.1であった。
ISIスコアの推移(FAS) 記事/インライン画像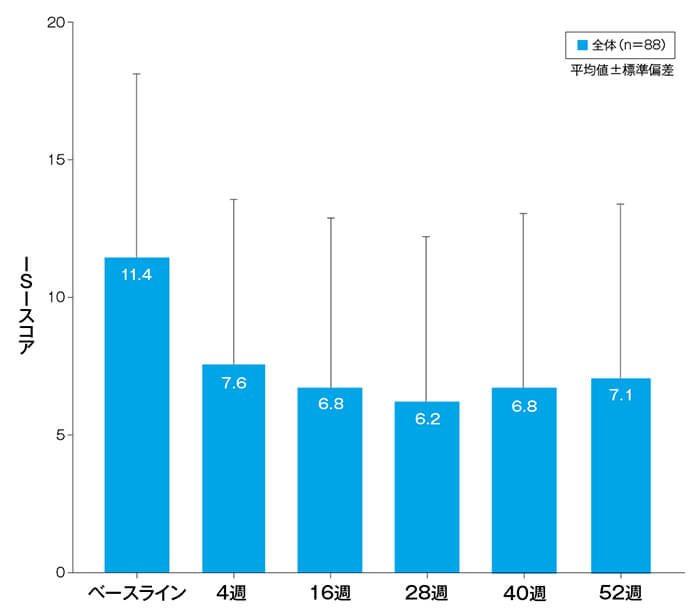
ISIの詳細はこちら
安全性
- 死亡及びその他の重篤な副作用、投与中止に至った副作用について
-
死亡及びその他の重篤な副作用、投与中止に至った副作用について
死亡に至った副作用は認められなかった。重篤な副作用は5例で5件(医療従事者による投与群2例2件、自己注射群3例3件)であり、その内訳は視神経炎、膿痂疹、蜂巣炎(2件のうち1件)、ウイルス感染及び節外性辺縁帯B細胞リンパ腫(MALT型)であった。投与中止に至った副作用(休薬を含む)は10例で16件(医療従事者による投与群4例8件、自己注射群6例8件)であり、投与中止に至った副作用の内訳はアトピー性皮膚炎(5件)、中毒性皮疹(3件)、カポジ水痘様発疹、膿痂疹、びまん性脱毛症、関節痛、末梢性ニューロパチー、末梢性浮腫、視神経炎及び節外性辺縁帯B細胞リンパ腫(MALT型)(各1件)であった。
副作用発現状況(SAF)
医療従事者による
投与群
(n=44)自己注射群
(n=44)全体
(n=88)全副作用 26(59.1) 24(54.5) 50(56.8) 重篤な副作用 2(4.5) 3(6.8) 5(5.7) 死亡に至った副作用 0 0 0 投与中⽌に⾄った副作⽤
(休薬を含む)4(9.1) 6(13.6) 10(11.4) 投与中止 2(4.5) 5(11.4) 7(8.0) 休薬 2(4.5) 1(2.3) 3(3.4) 減量 0 0 0 注目すべき副作用 注射関連の反応 3(6.8) 0 3(3.4) 喘息 0 0 0 アトピー性皮膚炎の悪化 9(20.5) 12(27.3) 21(23.9) 皮膚感染症 9(20.5) 7(15.9) 16(18.2) 皮膚以外の感染症 1(2.3) 2(4.5) 3(3.4) CPK上昇 0 0 0 治験薬からの
感染病原体感染の疑い0 0 0 例数(%)
フォローアップ期間に発現した事象も集計に含めた。MedDRA/J Version 20.1
副作⽤について
副作用は、88例中50例(56.8%)で122件(医療従事者による投与群では44例中26例[59.1%]で67件、自己注射群では44例中24例[54.5%]で55件)認められた。全体で認められた主な副作用はアトピー性皮膚炎、蜂巣炎、膿痂疹、頭痛、中毒性皮疹等であった。
副作用(SAF)
| 医療従事者による 投与群 (n=44) |
自己注射群 (n=44) |
全体 (n=88) |
|
|---|---|---|---|
| 感染症および寄生虫症 | 11(25.0) | 12(27.3) | 23(26.1) |
| 蜂巣炎 | 2(4.5) | 3(6.8) | 5(5.7) |
| 膿痂疹 | 2(4.5) | 2(4.5) | 4(4.5) |
| カポジ水痘様発疹 | 1(2.3) | 2(4.5) | 3(3.4) |
| 帯状疱疹 | 1(2.3) | 1(2.3) | 2(2.3) |
| 感染 | 1(2.3) | 1(2.3) | 2(2.3) |
| 歯冠周囲炎 | 1(2.3) | 1(2.3) | 2(2.3) |
| 眼部単純ヘルペス | 1(2.3) | 1(2.3) | 2(2.3) |
| 膿疱性ざ瘡 | 1(2.3) | 0 | 1(1.1) |
| 丹毒 | 1(2.3) | 0 | 1(1.1) |
| 伝染性軟属腫 | 1(2.3) | 0 | 1(1.1) |
| 爪囲炎 | 0 | 1(2.3) | 1(1.1) |
| 皮膚感染 | 0 | 1(2.3) | 1(1.1) |
| 足部白癬 | 0 | 1(2.3) | 1(1.1) |
| ウイルス感染 | 0 | 1(2.3) | 1(1.1) |
| 感染性腸炎 | 0 | 1(2.3) | 1(1.1) |
| 感染性皮膚嚢腫 | 0 | 1(2.3) | 1(1.1) |
| 良性、悪性および詳細不明の新生物 (嚢胞およびポリープを含む) |
1(2.3) | 1(2.3) | 2(2.3) |
| 皮膚乳頭腫 | 1(2.3) | 0 | 1(1.1) |
| 節外性辺縁帯B細胞リンパ腫 (MALT型) |
0 | 1(2.3) | 1(1.1) |
| 精神障害 | 2(4.5) | 0 | 2(2.3) |
| 双極1型障害 | 1(2.3) | 0 | 1(1.1) |
| うつ病 | 1(2.3) | 0 | 1(1.1) |
| 不眠症 | 1(2.3) | 0 | 1(1.1) |
| 神経系障害 | 5(11.4) | 1(2.3) | 6(6.8) |
| 頭痛 | 3(6.8) | 1(2.3) | 4(4.5) |
| 末梢性ニューロパチー | 1(2.3) | 0 | 1(1.1) |
| 視神経炎 | 1(2.3) | 0 | 1(1.1) |
| 傾眠 | 1(2.3) | 0 | 1(1.1) |
| 眼障害 | 3(6.8) | 0 | 3(3.4) |
| アレルギー性結膜炎 | 1(2.3) | 0 | 1(1.1) |
| 眼脂 | 1(2.3) | 0 | 1(1.1) |
| 緑内障 | 1(2.3) | 0 | 1(1.1) |
| 耳および迷路障害 | 1(2.3) | 2(4.5) | 3(3.4) |
| 回転性めまい | 1(2.3) | 1(2.3) | 2(2.3) |
| 外耳の炎症 | 0 | 1(2.3) | 1(1.1) |
| 呼吸器、胸郭および縦隔障害 | 3(6.8) | 0 | 3(3.4) |
| 咳嗽 | 3(6.8) | 0 | 3(3.4) |
| 胃腸障害 | 2(4.5) | 4(9.1) | 6(6.8) |
| 齲歯 | 1(2.3) | 1(2.3) | 2(2.3) |
| 腹部不快感 | 1(2.3) | 0 | 1(1.1) |
| 下腹部痛 | 1(2.3) | 0 | 1(1.1) |
| 上腹部痛 | 1(2.3) | 0 | 1(1.1) |
| 便秘 | 0 | 1(2.3) | 1(1.1) |
| 胃ポリープ | 0 | 1(2.3) | 1(1.1) |
| 胃食道逆流性疾患 | 0 | 1(2.3) | 1(1.1) |
| 皮膚および皮下組織障害 | 17(38.6) | 15(34.1) | 32(36.4) |
| アトピー性皮膚炎 | 9(20.5) | 12(27.3) | 21(23.9) |
| 中毒性皮疹 | 1(2.3) | 3(6.8) | 4(4.5) |
| 皮膚炎 | 0 | 2(4.5) | 2(2.3) |
| 紅斑 | 1(2.3) | 1(2.3) | 2(2.3) |
| 蕁麻疹 | 2(4.5) | 0 | 2(2.3) |
| びまん性脱毛症 | 1(2.3) | 1(2.3) | 2(2.3) |
| 脱毛症 | 1(2.3) | 0 | 1(1.1) |
| 円形脱毛症 | 1(2.3) | 0 | 1(1.1) |
| 水疱 | 0 | 1(2.3) | 1(1.1) |
| 接触皮膚炎 | 0 | 1(2.3) | 1(1.1) |
| 剥脱性皮膚炎 | 1(2.3) | 0 | 1(1.1) |
| 異汗性湿疹 | 0 | 1(2.3) | 1(1.1) |
| 湿疹 | 1(2.3) | 0 | 1(1.1) |
| 皮膚剥脱 | 1(2.3) | 0 | 1(1.1) |
| 爪色素沈着 | 1(2.3) | 0 | 1(1.1) |
| 筋骨格系および結合組織障害 | 2(4.5) | 0 | 2(2.3) |
| 関節痛 | 1(2.3) | 0 | 1(1.1) |
| 頚部痛 | 1(2.3) | 0 | 1(1.1) |
| 一般・全身障害および投与部位の状態 | 3(6.8) | 2(4.5) | 5(5.7) |
| 末梢性浮腫 | 1(2.3) | 1(2.3) | 2(2.3) |
| 疼痛 | 1(2.3) | 1(2.3) | 2(2.3) |
| 注射部位紅斑 | 1(2.3) | 0 | 1(1.1) |
| 注射部位不快感 | 1(2.3) | 0 | 1(1.1) |
| 臨床検査 | 1(2.3) | 3(6.8) | 4(4.5) |
| サイトカイン異常 | 1(2.3) | 1(2.3) | 2(2.3) |
| 体重増加 | 0 | 1(2.3) | 1(1.1) |
| 肝機能検査値上昇 | 0 | 1(2.3) | 1(1.1) |
同一患者において同じ副作用が複数回発現した場合、発現例数は1件としてカウントした。
フォローアップ期間に発現したものも集計に含めた。
MedDRA/J Version 20.1
- 5. 効能・効果に関連する注意(抜粋)
-
- 5.1
- ステロイド外用剤やタクロリムス外用剤等の抗炎症外用剤及び抗ヒスタミン剤等の抗アレルギー剤による適切な治療を一定期間施行しても、そう痒を十分にコントロールできない患者に投与すること。[17.1.1参照]
- 5.2
- 本剤はそう痒を治療する薬剤であり、そう痒が改善した場合も含め、本剤投与中はアトピー性皮膚炎に対して必要な治療を継続すること。[8.1参照]
- 6. 用法・用量
- 通常、成人及び13歳以上の小児にはネモリズマブ(遺伝子組換え)として1回60mgを4週間の間隔で皮下投与する。
- 7. 用法・用量に関連する注意
-
- 7.1
- 本剤投与後に浮腫性紅斑、湿疹等の発現を含む、皮膚症状の悪化が認められているので、皮膚症状が悪化した場合には、本剤の継続の可否について慎重に検討すること。
- 7.2
- 本剤とミチーガ皮下注用30mgバイアルの生物学的同等性は示されていないことから、互換使用を行わないこと。
- 8. 重要な基本的注意
-
- 8.1
- 以下の点について患者に説明し、理解したことを確認したうえで投与すること。[5.2-5.4参照]
•本剤はそう痒を治療する薬剤であることから、アトピー性皮膚炎に対する治療を継続すること。
•そう痒が改善した場合もアトピー性皮膚炎に対する治療を怠らないこと。
- 8.2
- 本剤投与中の患者に生ワクチンを接種する場合は、患者の状態を慎重に確認し、十分な注意を払うこと。
- 8.3
- 本剤の投与開始にあたっては、医療施設において、必ず医師によるか、医師の直接の監督の下投与を行うこと。
自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施した後、本剤投与による危険性と対処法について患者が理解し、患者自ら確実に投与できることを確認した上で、医師の管理指導の下実施すること。
自己投与の適用後、本剤による副作用が疑われる場合や自己投与の継続が困難な状況となる可能性がある場合には、直ちに自己投与を中止させ、医師の管理の下慎重に観察するなど適切な処置を行うこと。また、本剤投与後に副作用の発現が疑われる場合は、医療施設へ連絡するよう患者に指導を行うこと。
使用済みの注射器を再使用しないように患者に注意を促し、すべての器具の安全な廃棄方法に関する指導を行うと同時に、使用済みの注射器を廃棄する容器を提供すること。



