ヒルドイドフォーム0.3%の臨床試験結果
ヒルドイドフォーム0.3%の有効性及び安全性の検討試験
- 皮脂欠乏症患者を対象とした一般臨床試験(非対照非盲検多施設共同)1)
-
試験概要
- 目的
- ヒルドイドソフト軟膏0.3%からヒルドイドフォーム0.3%への切り替え後の有効性及び安全性を確認する。
- 対象
-
20歳以上の皮脂欠乏症※1患者60例(男性13例、女性47例、平均年齢54歳)
- 治療開始日に体幹、上肢又は下肢のいずれかの皮膚において、皮膚所見スコア(皮膚乾燥・鱗屑)がいずれも1以上の皮疹を有する
皮脂欠乏症の病変部位 部位 治療開始日の皮脂欠乏症の
病変部位治療開始日に選択した
有効性評価対象部位体幹 3(5.0) 0 上肢 9(15.0) 1(1.7) 大腿 3(5.0) 0 下腿 60(100) 59(98.3) 被験者60例の内訳 例数(%)
- 投与方法
- 患者は、試験担当医師に指示された部位の皮疹に対し、治療開始日から2週後の来院時までヒルドイドソフト軟膏0.3%を塗布し、2週後の来院時から4週後の来院時までヒルドイドフォーム0.3%を塗布した。両薬剤は1日2~3回、皮疹範囲に応じて試験担当医師から指示された量を塗布した。必要量は1FTU(約0.5g)を成人の手の面積2枚分程度に塗ることを基準として算出した。ヒルドイドソフト軟膏0.3%は1FTUが約0.5g、ヒルドイドフォーム0.3%は製品キャップ大が約1gであることを目安とした。
- スケジュール
-
記事/インライン画像

- 評価項目
-
〔有効性〕
主要評価項目:薬剤切り替え後の治療効果※2
副次評価項目:皮膚所見スコア(皮膚乾燥・鱗屑)の経時推移〔安全性〕
評価項目:有害事象(自覚症状及び他覚所見・臨床検査値異常変動)と臨床検査値- ※2試験担当医師は、有効性評価対象部位の4週後の治療効果を2週後と比較し、「治療効果が維持された」「治療効果が維持されなかった」の2段階で評価した
- 解析方法
-
有効性についてはFAS※3を主たる解析対象集団とした。安全性については安全性に関するデータが1つもない症例を除いた集団を解析対象集団とした。また、薬剤切り替え後の治療効果の判定が欠測の場合は、「治療効果が維持されなかった」として扱った。
- ※3FAS(Full Analysis Set):最大の解析対象集団
結果
- 結果① ヒルドイドソフト軟膏0.3%からヒルドイドフォーム0.3%への切り替え後の治療効果[主要評価項目]
-
皮脂欠乏症患者において、ヒルドイドソフト軟膏0.3%からヒルドイドフォーム0.3%への切り替えにより治療効果が維持された割合は98.3%(59/60例)であった。
薬剤切り替え後の治療効果(FAS) 記事/インライン画像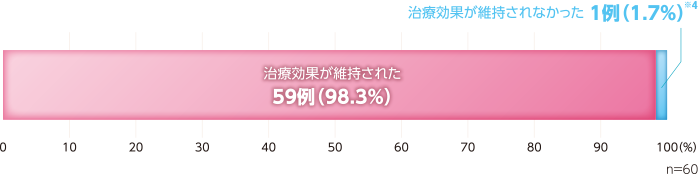
- ※4この1例は、4週後来院日が許容範囲外であったため治療効果によらず「治療効果が維持されなかった」として取り扱った
- 結果② 皮膚所見スコア(皮膚乾燥・鱗屑)の経時推移[副次評価項目]
-
- 皮膚乾燥スコアの平均値(標準偏差、以下S.D.)は、治療開始日が2.3(0.8)、2週後が1.1(0.7)、3週後が0.7 (0.5)、4週後が0.5(0.5)であった。個々の患者スコアは、薬剤切り替え後の悪化はみられず、全例が改善又は不変であった。
- 鱗屑スコアの平均値(S.D.)は、治療開始日が2.2(0.8)、2週後が0.3(0.4)、3週後が0.1(0.2)、4週後が0であった。個々の患者スコアは、薬剤切り替え後の悪化はみられず、全例が改善又は不変であった。
皮膚所見スコア(FAS) 記事/インライン画像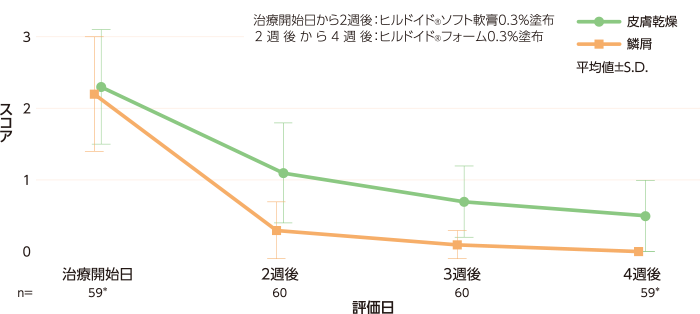
評価基準:皮膚所見スコア
有効性評価対象部位の皮膚乾燥、鱗屑の重症度を以下の5段階の評価基準に従い、スコアにより試験担当医師が評価した。スコア 皮膚乾燥 0 なし 皮膚乾燥は認められない 1 軽微 皮膚がごくわずかに乾燥している 2 軽度 皮膚がわずかに乾燥している 3 中等度 皮膚が明らかに乾燥している 4 高度 皮膚が高度に乾燥している スコア 鱗屑 0 なし 鱗屑は認められない 1 軽微 ごくわずかに鱗屑が認められる 2 軽度 わずかに鱗屑が認められる 3 中等度 明らかに鱗屑が認められる 4 高度 大量の鱗屑が認められる - *治療開始日及び4週後は、許容範囲外に来院した1例を欠測データとした
副作用
副作用は治療期間1(ヒルドイドソフト軟膏0.3%)において60例中2例(3.3%)に、治療期間2(ヒルドイドフォーム0.3%)においては60例中1例(1.7%)に認められた。重篤な副作用及び投与中止に至った副作用は認められなかった。
ヒルドイドソフト軟膏0.3% ヒルドイドフォーム0.3% 安全性解析対象集団 60 60 副作用発現例数(%) 2(3.3%) 1(1.7%) 副作用の種類 副作用発現例数(%) ヒルドイドソフト軟膏0.3% ヒルドイドフォーム0.3% 一般・全身障害及び投与部位の状態 2(3.3%) 0 適用部位刺激感 1(1.7%) 0 適用部位そう痒感 1(1.7%) 0 皮膚及び皮下組織障害 0 1(1.7%) 紅斑 0 1(1.7%) そう痒症 0 1(1.7%) 1) 川島眞ほか:皮膚の科学, 16(5), 356, 2017 より一部改変
[利益相反]本試験に関する費用負担はマルホ株式会社が行った。著者のうち2名はマルホ株式会社の社員である。



