エピデュオの尋常性ざ瘡患者を対象とした海外第Ⅲ相比較試験メタアナリシス(海外データ)
- 目的
- 尋常性ざ瘡患者に対するエピデュオゲルの有効性および安全性についてアダパレン0.1%ゲル、BPO2.5%ゲル、ゲル基剤を対照として検討する。
- 試験デザイン
- 無作為化、二重盲検、並行群間、多施設共同の3試験※1のメタアナリシス
※1:Thiboutot DM et al.: J Am Acad Dermatol.57(5),791-799(2007)、Gold LS et al.: Cutis. 84(2),110-116(2009)、Gollnick HP et al.: Br J Dermatol. 161(5),1180-1189(2009) - 対象
- 12歳以上で、顔面(鼻を除く)の炎症性皮疹(丘疹、膿疱)が20~50個、非炎症性皮疹(開放面皰、閉鎖面皰)が30~100個の尋常性ざ瘡患者3855例(男性1852例、女性2003例)。なお、結節性のざ瘡皮疹が2個以上※2または嚢腫がある場合は除外した。
※2:3試験中1試験において結節性のざ瘡皮疹がある場合は除外した - 割付方法
- エピデュオゲル群、アダパレン0.1%ゲル群、BPO2.5%ゲル群またはゲル基剤群に割り付けた。
- 用法・用量および投与期間
- 各試験薬を1日1回(夜)、洗顔後に顔面全体(口唇、眼周囲および小鼻を除く)に12週間塗布した。
- 有効性および安全性解析対象集団
- エピデュオゲル群 983例、アダパレン0.1%ゲル群 986例、BPO2.5%ゲル群 979例、ゲル基剤群 907例 計3855例
- 評価項目
-
[有効性]
主要評価項目- 奏効率(%)※3
- 皮疹数※4のベースラインからの変化率(%)
- 有害事象
- 局所刺激性評価(紅斑、落屑、皮膚乾燥、刺痛感/灼熱感)※5
- IGAスケールで「0=皮疹消失」または「1=ほぼ皮疹消失」と判定された患者の割合
- 総皮疹数、炎症性皮疹数、非炎症性皮疹数
- 詳細は「局所刺激性評価における重症度判定基準」を参照(海外第Ⅲ相比較試験メタアナリシスではそう痒感は除く)
- 解析計画
- 有効性はCochran-Mantel-Haenszel検定で評価した(有意水準両側5%)。リジット解析により変化量は変化率に変換した。相乗効果は下記のとおり定義して算出した。安全性は安全性解析対象集団を対象に評価した。
- 相乗効果の計算方法
-
- 基剤による効果を考慮するため、各単剤とゲル基剤との差を求めた。
各治療薬のベネフィット = 治療による効果 - 基剤の効果 - 相乗効果は、各単剤のベネフィットの合計よりエピデュオゲルのベネフィットが大きい場合と定義した。
相乗効果 = エピデュオゲルのベネフィット -(アダパレン0.1%ゲルのベネフィット + BPO2.5%ゲルのベネフィット) > 0
- 基剤による効果を考慮するため、各単剤とゲル基剤との差を求めた。
IGAスケール
- 0
- 皮疹消失
- 残留色素沈着および紅斑が認められることがある。
- 1
- ほぼ皮疹消失
- 面皰が少数点在し、小丘疹が少数(5個未満)∗1存在する。
- 2
- 軽度
- 容易に識別でき、顔面の半分未満にざ瘡が認められる。いくつかの面皰、いくつか(5個以上)∗1の丘疹や膿疱が存在する。
- 3
- 中等度
- 顔面の半分以上にざ瘡が認められる。多数の面皰、丘疹、膿疱が存在する∗2。
- 4
- 重度
- 顔面全体にざ瘡が認められる。面皰、丘疹、膿疱に覆われ、結節や嚢胞はほとんど存在しない。
- 5
- 極めて重度∗3
- 顔面が炎症性の高いざ瘡に覆われ、結節や嚢胞が存在する。
- *1: 3試験中2試験において丘疹数の定義はない
- *2: 3試験中2試験において1つの小結節が存在することがある
- *3: 3試験中2試験において極めて重度の重症度レベルは存在しない
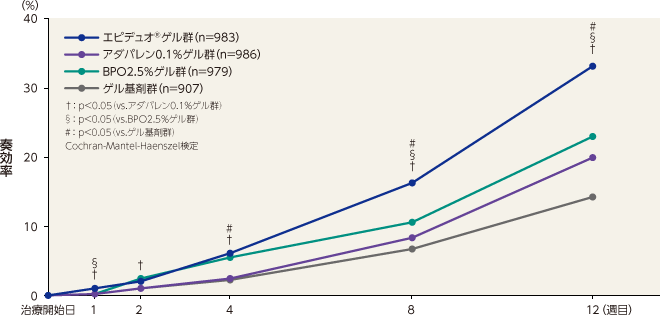
奏効率(主要評価項目)
12週目の奏効率はエピデュオゲル群が33.1%、アダパレン0.1%ゲル群が20.0%、BPO2.5%ゲル群が23.1%、ゲル基剤群が14.2%であった。エピデュオゲル群は8週目および12週目に各単剤群およびゲル基剤群に対して有意な差が認められた。
皮疹数の変化率(主要評価項目)
- 〈総皮疹数〉
-
総皮疹数のベースラインから12週目までの変化率(中央値)は、エピデュオゲル群が -59%、アダパレン0.1%ゲル群が-47%、BPO2.5%ゲル群が -46%、ゲル基剤群が -33%であった。
エピデュオゲル群は1週目以降すべての評価時点で各単剤群およびゲル基剤群と比較して有意な差が認められた。記事/インライン画像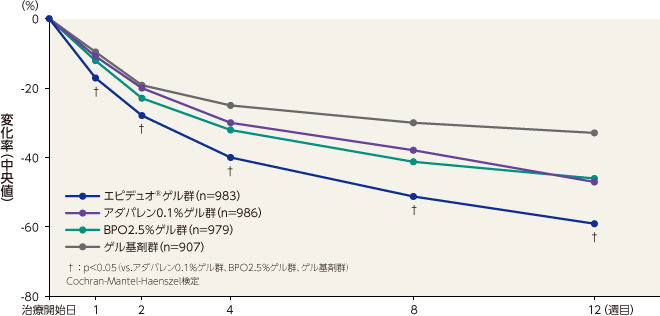
- 〈炎症性皮疹数〉
-
炎症性皮疹数のベースラインから12週目までの変化率(中央値)は、エピデュオゲル群が -66%、アダパレン0.1%ゲル群が -52%、BPO2.5%ゲル群が -57%、ゲル基剤群が -38%であった。エピデュオゲル群は1週目以降すべての評価時点で各単剤群およびゲル基剤群と比較して有意な差が認められた。
記事/インライン画像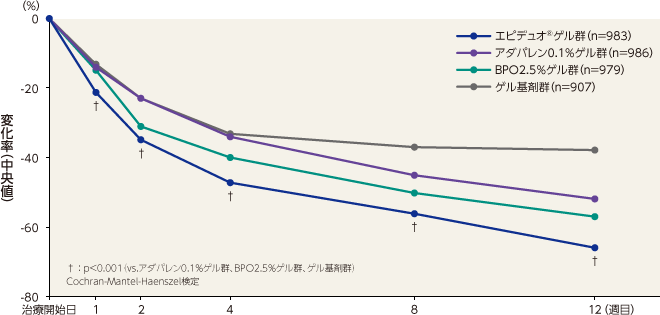
- 〈非炎症性皮疹数〉
-
非炎症性皮疹数のベースラインから12週目までの変化率(中央値)は、エピデュオゲル群が -58%、アダパレン0.1%ゲル群が -48%、BPO2.5%ゲル群が -45%、ゲル基剤群が -33%であった。エピデュオゲル群は1週目以降すべての評価時点で各単剤群およびゲル基剤群と比較して有意な差が認められた。
記事/インライン画像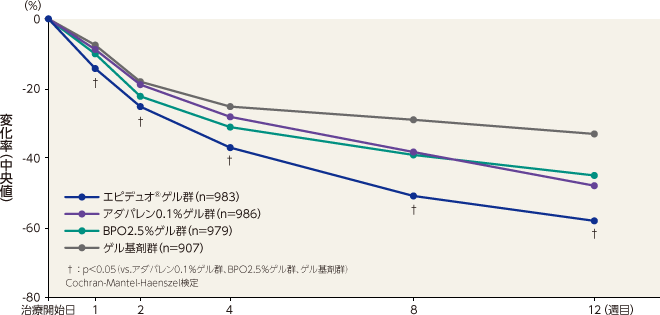
相乗効果※
エピデュオゲルとゲル基剤との差が、各単剤とゲル基剤との差の総和より大きい場合を相乗効果とみなす
- 〈奏効率〉
-
奏効率は、1週目、4週目、8週目および12週目において、エピデュオゲル群とゲル基剤群との差が、各単剤群とゲル基剤群との差の総和よりも大きくなり、相乗効果が認められた。
記事/インライン画像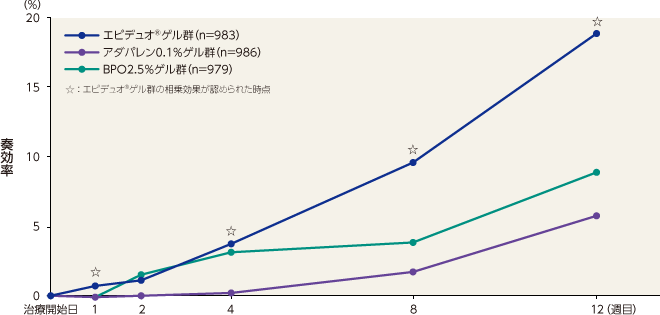
- 〈総皮疹数〉
-
総皮疹数のベースラインから12週目までの変化率(中央値)は、1週目、2週目、4週目および8週目において、エピデュオゲル群とゲル基剤群との差が、各単剤群とゲル基剤群との差の総和よりも大きくなり、相乗効果が認められた。
記事/インライン画像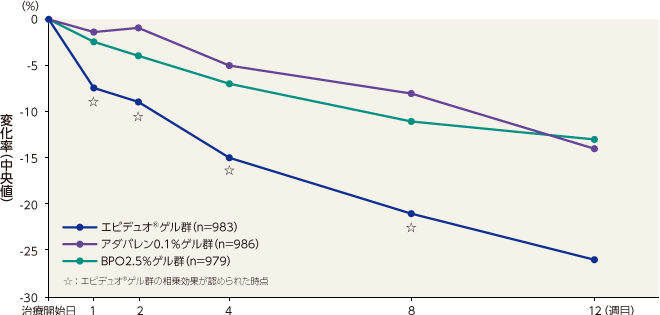
- 〈炎症性皮疹数〉
-
炎症性皮疹数のベースラインから12週目までの変化率(中央値)は、1週目、2週目および4週目において、エピデュオゲル群とゲル基剤群との差が、各単剤群とゲル基剤群との差の総和よりも大きくなり、相乗効果が認められた。
記事/インライン画像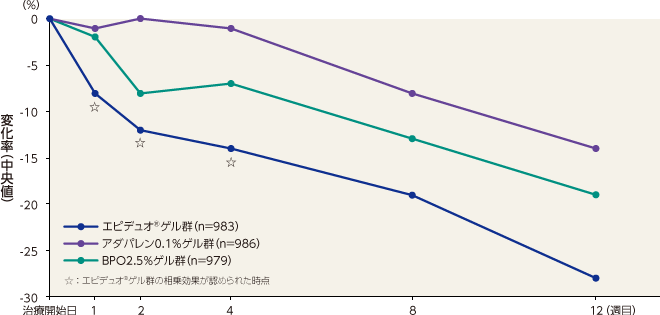
- 〈非炎症性皮疹数〉
-
非炎症性皮疹数のベースラインから12週目までの変化率(中央値)は、1週目、2週目、4週目および8週目において、エピデュオゲル群とゲル基剤群との差が、各単剤群とゲル基剤群との差の総和よりも大きくなり、相乗効果が認められた。
記事/インライン画像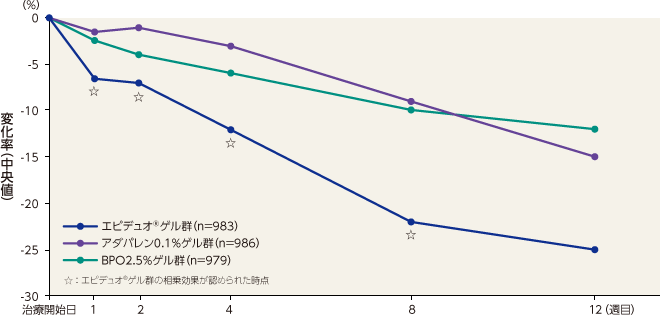
海外第Ⅲ相比較試験メタアナリシスにおける副作用
副作用はエピデュオゲル群で983例中212例(21.6%)、アダパレン0.1%ゲル群で986例中151例(15.3%)、BPO2.5%ゲル群で979例中83例(8.5%)、ゲル基剤群で907例中54例(6.0%)に認められた。
投与中止に至った副作用はエピデュオゲル群で20例(2.0%)、アダパレン0.1%ゲル群で2例(0.2%)、BPO2.5%ゲル群で10例(1.0%)、ゲル基剤群で4例(0.4%)に認められた。海外第Ⅲ相比較試験メタアナリシスにおいて重篤な副作用は認められなかった。
〈いずれかの投与群で発現率が1%以上の副作用〉
| エピデュオゲル群 | アダパレン0.1%ゲル群 | BPO2.5%ゲル群 | ゲル基剤群 | |
|---|---|---|---|---|
| 安全性解析対象例数 | 983 | 986 | 979 | 907 |
| 副作用発現例数(%) | 212(21.6) | 151(15.3) | 83(8.5) | 54(6.0) |
| 副作用の種類 | 副作用発現例数(%) | |||
|---|---|---|---|---|
| エピデュオゲル群 | アダパレン0.1%ゲル群 | BPO2.5%ゲル群 | ゲル基剤群 | |
| 皮膚および皮下組織障害 | 207(21.1) | 140(14.2) | 78(8.0) | 52(5.7) |
| 皮膚乾燥 | 130(13.2) | 93(9.4) | 45(4.6) | 32(3.5) |
| 皮膚刺激 | 33(3.4) | 26(2.6) | 7(0.7) | 6(0.7) |
| 皮膚灼熱感 | 26(2.6) | 5(0.5) | 4(0.4) | 3(0.3) |
| 皮膚不快感 | 16(1.6) | 2(0.2) | 1(0.1) | 1(0.1) |
| 皮膚剥脱 | 13(1.3) | 8(0.8) | 5(0.5) | 1(0.1) |
| 紅斑 | 12(1.2) | 4(0.4) | 4(0.4) | 3(0.3) |
| そう痒症 | 12(1.2) | 9(0.9) | 16(1.6) | 5(0.6) |
〈投与中止に至った副作用の内訳〉
| 副作用の種類 | 副作用発現例数(%) | |||
|---|---|---|---|---|
| エピデュオゲル群 | アダパレン0.1%ゲル群 | BPO2.5%ゲル群 | ゲル基剤群 | |
| 皮膚および皮下組織障害 | 20(2.0) | 2(0.2) | 10(1.0) | 4(0.4) |
| 皮膚灼熱感 | 4(0.4) | - | 2(0.2) | - |
| 皮膚不快感 | 4(0.4) | - | - | - |
| 皮膚刺激 | 4(0.4) | 1(0.1) | 2(0.2) | 3(0.3) |
| 紅斑 | 3(0.3) | - | 2(0.2) | - |
| アレルギー性皮膚炎 | 2(0.2) | 1(0.1) | 1(0.1) | - |
| 接触性皮膚炎 | 2(0.2) | - | - | - |
| 皮膚乾燥 | 2(0.2) | - | - | - |
| 皮膚疼痛 | 2(0.2) | - | - | - |
| そう痒症 | 1(0.1) | - | 1(0.1) | - |
| ざ瘡 | - | - | 2(0.2) | 1(0.1) |
| アトピー性皮膚炎 | - | - | 1(0.1) | - |
| 皮膚剥脱 | - | - | 1(0.1) | - |
| 顔面腫脹 | - | - | 1(0.1) | - |
| 蕁麻疹 | - | - | - | - |
| 感染症および寄生虫症 | - | - | - | 1(0.1) |
| 膿痂疹 | - | - | - | 1(0.1) |
副作用名はMedDRA Ver.6.1でコーディングしたものをMedDRA/J Ver.15.0を用いて日本語に翻訳した。
<効能・効果に関連する使用上の注意>(一部抜粋)
- 結節及び嚢腫には、他の適切な処置を行うこと。
<用法・用量に関連する使用上の注意>(一部抜粋)
- 治療開始3ヵ月以内に症状の改善が認められない場合には使用を中止すること。
- 症状改善により本剤塗布の必要がなくなった場合は、塗布を中止し、漫然と長期にわたって使用しないこと。
〔使用上の注意〕
1. 重要な基本的注意(一部抜粋)
- 本剤はアダパレンと過酸化ベンゾイルの配合剤であり、各単剤よりも皮膚刺激が発現するおそれがあるため、本剤よりも先に各単剤による治療を考慮すること。



