エピデュオの尋常性ざ瘡患者を対象とした国内第Ⅲ相比較試験
- 目的
- 尋常性ざ瘡患者に対するエピデュオゲルの有効性についてアダパレン0.1%ゲルおよびBPO2.5%ゲルを対照として優越性を検討するとともに、忍容性および安全性プロファイルを検討する。
- 試験デザイン
- 実薬対照、無作為化、二重盲検、並行群間比較、多施設共同試験
- 対象
- 12歳以上、顔面(前額、両頬、鼻、下顎)の炎症性皮疹(丘疹、膿疱、結節)が12個以上100個以下、非炎症性皮疹(開放面皰、閉鎖面皰)が20個以上の尋常性ざ瘡患者417例(男性135例、女性282例)。なお、結節性のざ瘡皮疹が3個以上または嚢腫がある場合は除外した。
- 割付方法
- エピデュオゲル群、アダパレン0.1%ゲル群、BPO2.5%ゲル群に2:1:1の割合で割り付けた。
- 用法・用量および投与期間
- 各試験薬を1日1回(夕方から就寝前)、洗顔後に顔面全体(口唇および眼周囲を除く)に12週間塗布した。
- 有効性および安全性解析対象集団
- エピデュオゲル群 212例、アダパレン0.1%ゲル群 101例、BPO2.5%ゲル群 104例 計417例
- 評価項目
-
[有効性]
主要評価項目
最終評価時※1の総皮疹数※2の減少率(%)副次評価項目
- 炎症性皮疹数の減少率(%)
- 非炎症性皮疹数の減少率(%)
- ざ瘡改善率(%)※3
- 皮疹数※4
- 局所刺激性評価(紅斑、落屑、皮膚乾燥、そう痒感、刺痛感/灼熱感)※5
- 有害事象
- 臨床検査(血液学的検査、血液生化学的検査、尿検査)
- 身体所見
- バイタルサイン
患者満足度(ビジュアルアナログスケールにより評価)- ベースラインから12週後または中止時
- 炎症性皮疹数と非炎症性皮疹数の総数
- 総皮疹数の減少率が50%以上の患者の割合
- 総皮疹数、炎症性皮疹数、非炎症性皮疹数
- 詳細は「局所刺激性評価における重症度判定基準」を参照
- 解析計画
- 全ての有効性評価項目はITT集団を対象として来院日別、治療群別に要約した。主要評価項目に関して、エピデュオゲル群とアダパレン0.1%ゲル群およびBPO2.5%ゲル群をWilcoxon順位和検定で比較した(有意水準両側5%)。炎症性皮疹数および非炎症性皮疹数の減少率も同様にWilcoxon順位和検定で比較した(有意水準両側5%)。安全性データは安全性解析対象集団を対象に要約した。
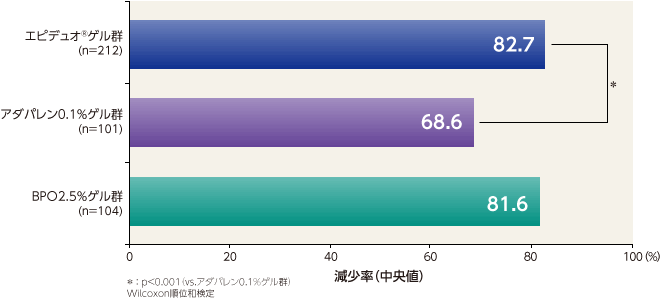
総皮疹数の減少率(主要評価項目)
最終評価時における総皮疹数の減少率(中央値)はエピデュオゲル群が82.7%、アダパレン0.1%ゲル群が68.6%、BPO2.5%ゲル群が81.6%であり、エピデュオゲル群とアダパレン0.1%ゲル群で比較したところ、有意な差が認められ、優越性が示された。エピデュオゲル群はアダパレン0.1%ゲル群と比較して1週目から有意な差が認められ、12週目まで持続した。エピデュオゲル群とBPO2.5%ゲル群で比較したところ、有意な差は認められなかった。
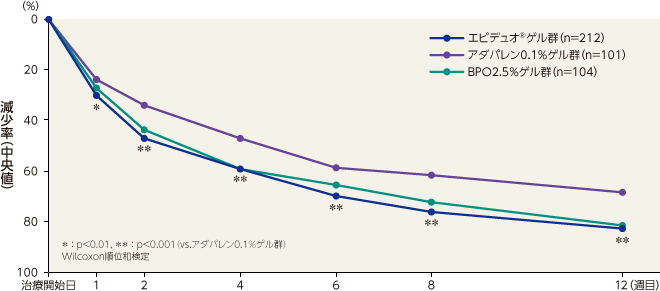
炎症性皮疹数の減少率(副次評価項目)
最終評価時における炎症性皮疹数の減少率(中央値)はエピデュオゲル群が84.6%、アダパレン0.1%ゲル群が71.4%、BPO2.5%ゲル群が86.7%であり、エピデュオゲル群とアダパレン0.1%ゲル群で比較したところ、有意な差が認められた。エピデュオゲル群はアダパレン0.1%ゲル群と比較して1週目から有意な差が認められ、12週目まで持続した。エピデュオゲル群とBPO2.5%ゲル群で比較したところ、有意な差は認められなかった。
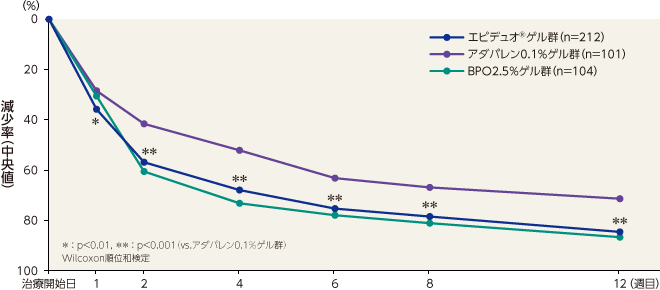
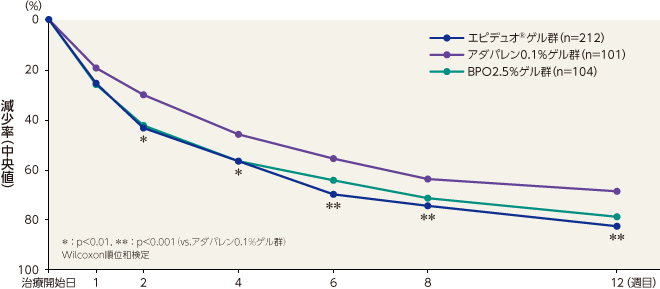
非炎症性皮疹数の減少率(副次評価項目)
最終評価時における非炎症性皮疹数の減少率(中央値)はエピデュオゲル群が82.8%、アダパレン0.1%ゲル群が68.6%、BPO2.5%ゲル群が78.8%であり、エピデュオゲル群とアダパレン0.1%ゲル群で比較したところ、有意な差が認められた。エピデュオゲル群はアダパレン0.1%ゲル群と比較して2週目から有意な差が認められ、12週目まで持続した。エピデュオゲル群とBPO2.5%ゲル群で比較したところ、有意な差は認められなかった。
本試験における副作用
副作用はエピデュオゲル群で212例中27例(12.7%)、アダパレン0.1%ゲル群で101例中3例(3.0%)、BPO2.5%ゲル群で104例中7例(6.7%)に認められた。投与中止に至った副作用はエピデュオゲル群で9例(皮膚刺激8例、アレルギー性皮膚炎1例)、アダパレン0.1%ゲル群で1例(皮膚刺激)、BPO2.5%ゲル群で3例(アレルギー性皮膚炎、日光皮膚炎、接触性皮膚炎が各1例)に認められた。本試験において重篤な副作用は認められなかった。
| エピデュオゲル群 | アダパレン0.1%ゲル群 | BPO2.5%ゲル群 | |
|---|---|---|---|
| 安全性解析対象例数 | 212 | 101 | 104 |
| 副作用発現例数(%) | 27(12.7) | 3(3.0) | 7(6.7) |
| 副作用の種類 | 副作用発現例数(%) | ||
|---|---|---|---|
| エピデュオゲル群 | アダパレン0.1%ゲル群 | BPO2.5%ゲル群 | |
| 眼障害 | - | - | 1(1.0) |
| 眼瞼浮腫 | - | - | 1(1.0) |
| 臨床検査 | 1(0.5) | - | - |
| 皮膚テスト陽性 | 1(0.5) | - | - |
| 皮膚および皮下組織障害 | 27(12.7) | 3(3.0) | 6(5.8) |
| 皮膚刺激 | 22(10.4) | 3(3.0) | 3(2.9) |
| 紅斑 | 2(0.9) | - | - |
| アレルギー性皮膚炎 | 1(0.5) | - | 1(1.0) |
| 皮膚びらん | 1(0.5) | - | - |
| 日光皮膚炎 | 1(0.5) | - | 1(1.0) |
| 接触性皮膚炎 | - | - | 1(1.0) |
同一患者に同一器官別大分類に該当する有害事象が複数発現した場合は、同一器官別大分類につき1回計上した。同様に、同一患者に同一基本語に該当する有害事象が複数発現した場合は、同一基本語につき1回計上した。
副作用名はMedDRA/J Ver.15.0の器官別大分類、基本語を用いて表示した。
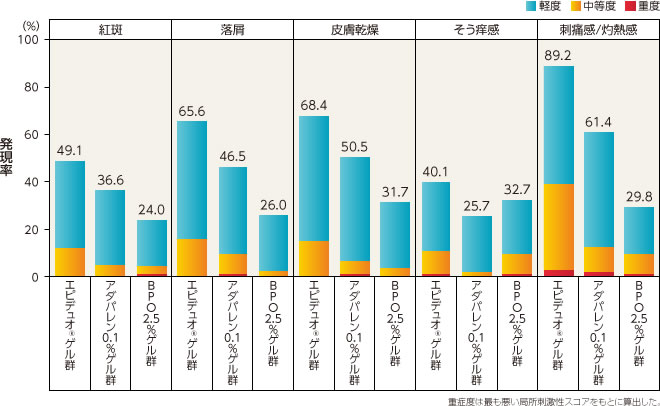
局所刺激性評価
エピデュオゲル群はアダパレン0.1%ゲル群、BPO2.5%ゲル群よりも、局所刺激性の発現した割合が高かった。
| 項目 | 程度 | スコア | 定義 |
|---|---|---|---|
| 紅斑 皮膚の異常な発赤 |
なし | 0 | 紅斑なし |
| 軽度 | 1 | わずかに赤色を呈する | |
| 中等度 | 2 | 明らかな発赤が認められる | |
| 重度 | 3 | 著しい発赤が認められる | |
| 落屑 過度な角質層の脱落 |
なし | 0 | 落屑なし |
| 軽度 | 1 | ほとんど見た目にはわからない落屑で、少し掻いたり擦ったりすれば気が付く程度 | |
| 中等度 | 2 | はっきりとわかるが量は多くない落屑 | |
| 重度 | 3 | 鱗屑が次々に剥がれ落ちてくる状態 | |
| 皮膚乾燥 ざらついた砕けやすい感触 |
なし | 0 | 皮膚乾燥なし |
| 軽度 | 1 | わずかに、しかし明らかに荒れている | |
| 中等度 | 2 | 中程度に荒れている | |
| 重度 | 3 | 著しく荒れている | |
| そう痒感 掻きたくなる感覚 |
なし | 0 | そう痒感なし |
| 軽度 | 1 | 時々わずかなかゆみが感じられるが、気になるほどではない | |
| 中等度 | 2 | 中程度にかゆみがあり、やや不快である | |
| 重度 | 3 | 強いかゆみがあり、かなり不快である | |
| 刺痛感/灼熱感 チクチクした痛み |
なし | 0 | 刺痛感/灼熱感なし |
| 軽度 | 1 | わずかな熱感、ヒリヒリ感、刺すような痛みがあるが、気になるほどではない | |
| 中等度 | 2 | はっきりした熱感、ヒリヒリ感、もしくは刺すような痛みがあり、やや不快である | |
| 重度 | 3 | 強い熱感、ヒリヒリ感、もしくは刺すような痛みがあり、かなり不快である |
<効能・効果に関連する使用上の注意>(一部抜粋)
- 結節及び嚢腫には、他の適切な処置を行うこと。
<用法・用量に関連する使用上の注意>(一部抜粋)
- 治療開始3ヵ月以内に症状の改善が認められない場合には使用を中止すること。
- 症状改善により本剤塗布の必要がなくなった場合は、塗布を中止し、漫然と長期にわたって使用しないこと。
〔使用上の注意〕(一部抜粋)
1. 重要な基本的注意(一部抜粋)
- 本剤はアダパレンと過酸化ベンゾイルの配合剤であり、各単剤よりも皮膚刺激が発現するおそれがあるため、本剤よりも先に各単剤による治療を考慮すること。
- 過敏症や重度皮膚刺激感が認められた場合は、本剤の使用を中止すること。
- 本剤の使用中に皮膚乾燥、皮膚不快感、皮膚剥脱、紅斑、そう痒症があらわれることがある。これらは治療開始2週間以内に発生することが多く、通常は軽度で一過性のものであることについて患者に説明すること。なお、本剤の継続使用中に消失又は軽減が認められない場合は、必要に応じて休薬等の適切な処置を行うこと。



