ゼビアックスの開発の経緯・特徴
開発の経緯
ゼビアックスローション2%及びゼビアックス油性クリーム2%は、富山化学工業株式会社にて創製されたキノロン系合成抗菌化合物であるオゼノキサシンを有効成分とする外用抗菌剤である。
オゼノキサシンは、細菌のデオキシリボ核酸(以下、DNA)複製に関与するDNAジャイレース及びトポイソメラーゼⅣを阻害して抗菌作用を発揮する1)。尋常性ざ瘡や表在性皮膚感染症の病態に関与するCutibacterium acnes (以下、C. acnes )、Staphylococcus epidermidis (以下、S. epidermidis )、Staphylococcus aureus (以下、S. aureus )を含む、各種好気性及び嫌気性のグラム陽性菌とグラム陰性菌に対して幅広い抗菌スペクトルを示した(in vitro )2)。また、尋常性ざ瘡あるいは表在性皮膚感染症患者から分離されたC. acnes 、S. epidermidis 、S. aureus 、その他のcoagulase-negative staphylococci (以下、CNS)、及び皮膚由来臨床分離methicillin-resistant S. aureus (以下、MRSA)に対して高い抗菌作用を示した(in vitro )2)~5)。これらのことから、オゼノキサシンが尋常性ざ瘡及び表在性皮膚感染症に対する新たな治療の選択肢となると考え、マルホ株式会社は外用抗菌剤としての開発を実施した。国内の臨床試験において1日1回塗布での有用性が認められ3,4,6)、2015年9月にゼビアックスローション2%として、ざ瘡(化膿性炎症を伴うもの)および表在性皮膚感染症の適応症で製造販売承認を取得した。
その後、2021年1月に、びらんの生じた伝染性膿痂疹や、乾燥・鱗屑等が生じた尋常性ざ瘡に適する剤形追加品として、ゼビアックス油性クリーム2%の製造販売承認を取得した。
- 社内資料(in vitro 抗菌作用機序)
- 社内資料(in vitro 各菌種に対する抗菌作用)
- 川島 眞ら:臨床医薬, 31(2), 155(2015)
- 川島 眞ら:臨床医薬, 31(3), 279(2015)
- 社内資料(in vitro MRSA等に対する抗菌活性)
- 川島 眞ら:臨床医薬, 31(2), 143(2015)
特徴
-
1.キノロン系合成抗菌化合物であるオゼノキサシンを有効成分とする外用抗菌剤である。
-
2.尋常性ざ瘡や表在性皮膚感染症の病態に関与するC.acnes 、S.epidermidis 、MRSAを含むS.aureus などに対して殺菌的な抗菌作用を示した(in vitro )1~4)。
-
3.1日1回塗布でざ瘡(化膿性炎症を伴うもの)および表在性皮膚感染症に対して効果を示す。
-
4.顔面に炎症性皮疹を伴う尋常性ざ瘡患者を対象としたプラセボおよび実薬対照、国内第Ⅲ相比較臨床試験(ローション剤)において、最終評価時の炎症性皮疹数の減少率は54.8%で、プラセボ群と比較して有意な差が認められた(p<0.001、2標本Wilcoxon検定)。
また、ナジフロキサシン群に対する非劣性が検証された5)。 -
5.表在性皮膚感染症患者を対象とした国内第Ⅲ相臨床試験(ローション剤)において、最終評価時の有効率は70.0%であった6)。
-
6.伝染性膿痂疹患者を対象とした国内第Ⅲ相試験(一般臨床試験・油性クリーム剤)において、最終評価時の有効率は97.6%であった2)。
-
7.ローション剤は、塗布後に垂れにくい製剤学的特性を有し、指先に取って塗布可能な粘性のある製剤である7)。
油性クリーム剤は、ローション剤よりも被覆性の高い製剤である8)。
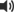
動画の再生時には音声が流れます
- 8.主な副作用は、乾燥(1%以上)、刺激感、鱗屑・落屑、紅斑(各1%未満)等であった。
詳細は、添付文書の副作用および臨床成績の安全性結果を参照
- 川島 眞ら:臨床医薬, 31(2),155(2015)
- 社内資料(伝染性膿痂疹患者を対象とした第Ⅲ相一般臨床試験)(承認時評価資料)
- 川島 眞ら:臨床医薬, 31(3), 279(2015)
- 社内資料(in vitro MRSA等に対する抗菌活性)
- 川島 眞ら : 臨床医薬, 31(2), 155(2015)
- 川島 眞ら : 臨床医薬, 31(3), 279(2015)
- 社内資料(ゼビアックスローション2%およびその類似薬を用いた製剤学的評価)
- 仲東 春香ら:薬学雑誌, 139(10), 1313(2019)