ゼビアックスの伝染性膿痂疹患者を対象とした第III相臨床試験
- 目的
- 伝染性膿痂疹患者に対する有効性、細菌学的効果および安全性の検討
- 試験デザイン
- 非対照、非盲検、多施設共同試験
- 対象
-
1歳以上、外用抗菌薬のみで治療可能※1な以下の選択基準に該当する伝染性膿痂疹患者
【選択基準】
伝染性膿痂疹の各皮膚症状スコア(発赤、水疱、膿疱、びらん、滲出液)が3項目以上で1(軽度)以上を示し、伝染性膿痂疹の皮疹から原因菌同定のための検体採取が可能な患者
- ※1: 面積の目安は硬貨4枚以下
- 方法
- ゼビアックス油性クリーム2%を1日1回7日間、伝染性膿痂疹のすべての皮疹に適量塗布した※2。
- ※2: 皮疹部へのゼビアックス油性クリーム2%以外の外用薬の使用、および内服抗菌薬の使用は禁止した。
- 有効性および
安全性解析対象集団 -
41例
- 評価方法
-
評価部位の皮膚症状(発赤、水疱、膿疱、びらん、滲出液)を項目ごとに「0:なし」「1:軽度」「2:中等度」「3:高度」の4段階でスコア化し(表1)、臨床効果の判定基準に従って、スコアの推移から「著効」、「有効」、「無効」、「判定不能」と判定した(表2)。
表1:皮膚症状スコア
症状 スコア 症状の程度 発赤 0:なし 発赤を認めない、または残存紅斑(病変部に残る暗紅色の炎症を伴わない紅斑)のみ発現している 1:軽度 熱感を伴わない発赤がわずかに発現している 2:中等度 熱感を伴う発赤が発現している、または発赤が広範囲に発現している 3:高度 熱感を伴う鮮紅色の発赤が広範囲に発現している 水疱 0:なし 水疱を認めない 1:軽度 少数の小水疱が発現している 2:中等度 漿液を含んだ水疱が発現している 3:高度 漿液を含んだ水疱が広範囲に発現している 膿疱 0:なし 膿疱を認めない 1:軽度 少数の膿疱が発現している 2:中等度 膿を含んだ膿疱が発現している 3:高度 膿を含んだ膿疱が広範囲に発現している びらん 0:なし びらんを認めない 1:軽度 わずかな範囲にびらんが発現している 2:中等度 びらんが発現している 3:高度 広範囲にびらんが発現している 滲出液 0:なし 滲出液を認めない 1:軽度 皮疹(びらん等)から少量の滲出液が確認できる 2:中等度 皮疹(びらん等)から滲出液が確認できる 3:高度 広範囲の皮疹(びらん等)から滲出液が確認できる 表2:臨床効果の判定基準 著効 すべての皮膚症状(発赤、水疱、膿疱、びらん、滲出液)が「なし」となった場合 有効 発赤、水疱、膿疱、びらん、滲出液のうち3項目以上について、「なし」または「皮膚症状スコアが2段階以上改善」となった場合 無効 「著効」または「有効」とならなかった場合 判定不能 皮膚症状スコアが欠測の場合 - 評価項目
-
[有効性]
最終評価時の有効率(臨床効果の判定基準で「著効」または「有効」であった被験者の割合)、臨床効果の判定(皮膚症状スコア)、細菌学的効果[安全性]
有害事象、臨床検査値 - 解析計画
- 最終評価時および各規定来院日の有効率に関しては、それぞれ有効例数、有効率および95%信頼区間を求めた。95%信頼区間はClopper-Pearsonの信頼区間を用いて算出した。治療3~4日後で完了基準に該当した場合は、その時点で投与を終了し治療7~8日後の来院日の観察・検査等は不要とした。各規定来院日の皮膚症状では、規定来院日ごとに各皮膚症状スコアの例数および割合を求めた。菌種の同定および菌陰性化では、規定来院日ごとにS.aureus が検出された例数および割合を求め、治療開始日にS.aureus が検出された被験者を対象に、規定来院日ごとにmethicillin-susceptible S.aureus (MSSA)およびMRSAが検出された例数とその割合を算出した。さらに、治療開始日に菌が検出された被験者を対象として菌陰性化例数および割合を算出した。なお、治療3~4日後以降に皮疹が消失し細菌学的検査が実施できない場合は、菌陰性と定義した。
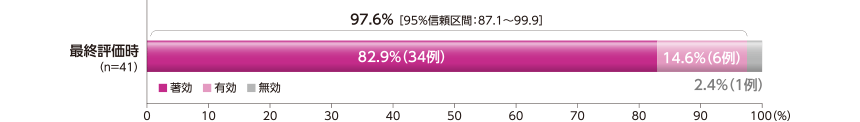
最終評価時の有効率
最終評価時の有効率は、97.6%(40/41例)であった。
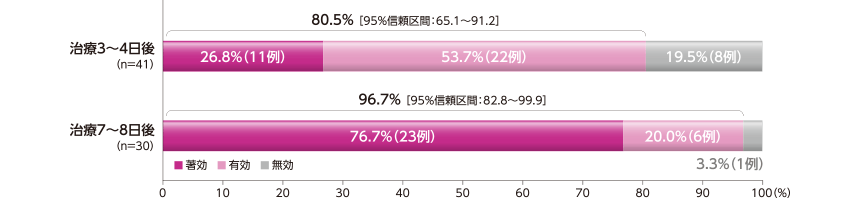
各規定来院日の有効率
各規定来院日の有効率は、治療3~4日後で80.5%(33/41例)、治療7~8日後で96.7%(29/30例)であった。
- 有効率:臨床効果の判定基準が「著効」または「有効」となった被験者の割合
- 95%信頼区間:Clopper-Pearsonの信頼区間を用いた
各規定来院日の皮膚症状
各皮膚症状スコアが「なし」と判定された被験者の割合は、治療開始日で0~43.9%、治療7~8日後で86.7~96.7%であった。
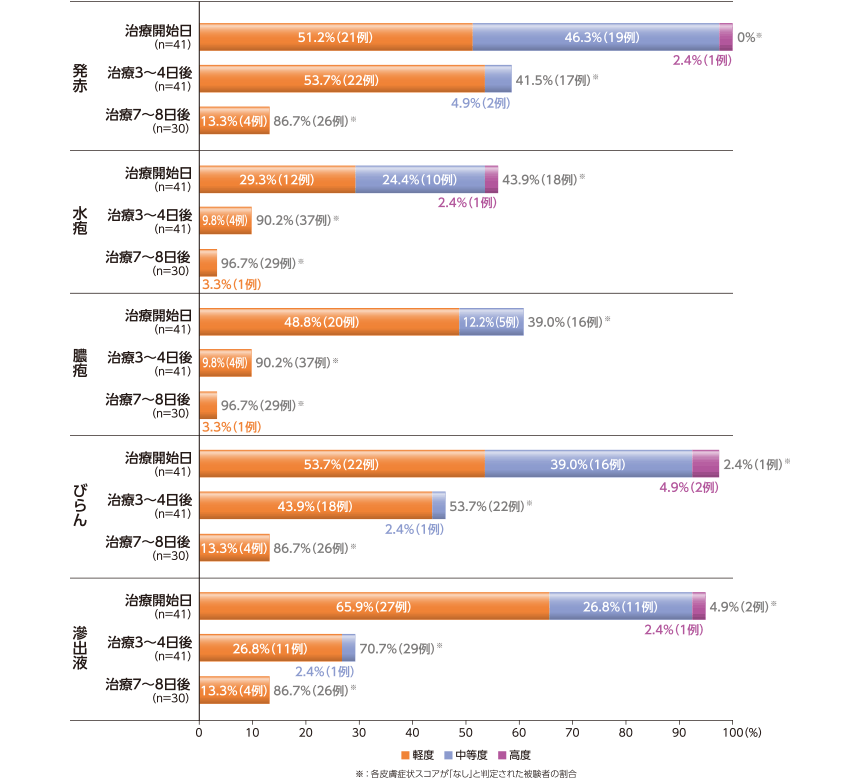
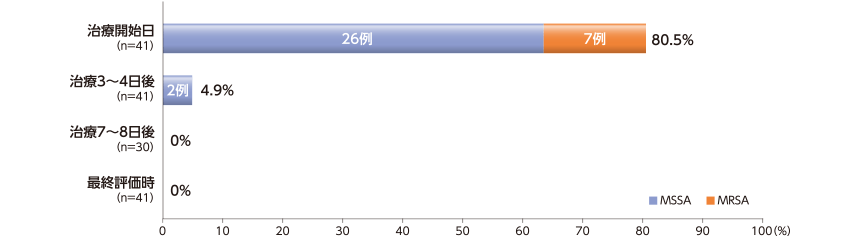
S.aureus が同定された割合および菌陰性化率
治療開始日にS.aureus が同定された被験者の割合は80.5%(33/41例)であった。内訳はメチシリン感受性黄色ブドウ球菌(MSSA)が78.8%(26/33例)、メチシリン耐性黄色ブドウ球菌(MRSA)が21.2%(7/33例)であった。
最終評価時には、S.aureus は検出されず、菌陰性化率は100%(33/33例)であった。
| 菌陰性化例数(%) | |
|---|---|
| 治療3~4日後(n=33) | 31(93.9) |
| 治療7~8日後(n=26) | 26(100) |
| 最終評価時(n=33) | 33(100) |
対象:治療開始日に菌が検出された被験者
投与期間
投与期間は7日未満が26.8%(11/41例)、7日間が73.2%(30/41例)であった。
| 投与期間※ | 例数(%) |
|---|---|
| 7日未満 | 11(26.8) |
| 7日 | 30(73.2) |
| 8日以上 | 0 |
※:最終投与日-初回投与日+1
本試験における副作用
本試験では副作用は報告されなかった。
(MedDRA/J Ver.15.0)
5. 効能・効果に関連する注意
結節及び嚢腫には、他の適切な治療を行うこと。
7. 用法・用量に関連する注意(一部抜粋)
<表在性皮膚感染症>
7.1 1週間で効果が認められない場合は使用を中止すること。
8. 重要な基本的注意
本剤の使用にあたっては、耐性菌の発現等を防ぐため、疾病の治療上必要な最小限の期間の使用にとどめること。
社内資料(伝染性膿痂疹患者を対象とした第Ⅲ相一般臨床試験)(承認時評価資料)



