ゼビアックスの尋常性ざ瘡患者を対象とした第Ⅲ相比較臨床試験
- 試験デザイン
- プラセボおよび実薬対照、ランダム化、評価者盲検、並行群間比較、多施設共同試験
- 対象
- 13歳以上50歳未満、顔面(眼瞼および口唇を除く)に11個以上40個以下の炎症性皮疹(紅色丘疹と膿疱の合計)を伴う尋常性ざ瘡患者
- 方法
-
観察期間(治療開始日前の2週間)にプラセボ※を塗布後、治療期間(12週間)は以下の3群に患者を割り付け、各試験薬を塗布した。塗布方法は、1日2回(朝および夜)、洗顔後に顔面のすべての尋常性ざ瘡の皮疹に適量塗布した。なお、ゼビアックスローション2%の用法は1日1回のため、朝はプラセボを塗布した。
※オゼノキサシンを含有しないローション剤投与群 朝 夜 ゼビアックス群 プラセボ ゼビアックスローション2% ナジフロキサシン群 1%ナジフロキサシンローション 1%ナジフロキサシンローション プラセボ群 プラセボ プラセボ - 有効性および
安全性解析対象集団 - ゼビアックス群:204例、ナジフロキサシン群:198例、プラセボ群:97例
- 評価項目
-
[主要評価項目]
治療開始日に対する最終評価時(12週後または中止日までの最終の評価日)の炎症性皮疹数の減少率[副次評価項目]
最終評価時の炎症性皮疹数の減少数、4週後の炎症性皮疹数の減少率および減少数、炎症性皮疹数の経時推移、細菌学的検査[安全性]
有害事象、臨床検査値 - 解析方法
- 投与群別に要約統計量を算出した。主要評価項目に関しては、ゼビアックス群とプラセボ群を2標本Wilcoxon検定で対比較(有意水準両側5%)し、優越性を検証した。
優越性が検証できた場合は、ゼビアックス群とナジフロキサシン群の中央値の差に対するホッジス・レーマン推定値の95%信頼区間下限が非劣性限界値-10.1%を上回っていることにより、非劣性を検証した。副次評価項目では、それぞれの中央値の差のホッジス・レーマン推定値とその95%信頼区間を算出した(有意水準両側5%)。
炎症性皮疹数の減少率(最終評価時):主要評価項目
最終評価時の炎症性皮疹数の減少率は、ゼビアックス群が54.77%、ナジフロキサシン群が53.59%、プラセボ群が41.67%で、ゼビアックス群はプラセボ群と比較して有意な差が認められた。また、ゼビアックス群のナジフロキサシン群に対する非劣性が検証された。
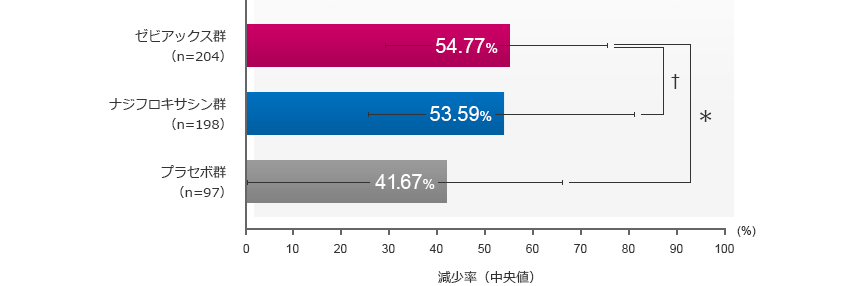
中央値±四分位範囲
- *:p<0.001 2標本Wilcoxon検定(vs.プラセボ群)
- †:ホッジス・レーマン推定値(95%信頼区間)0.00%(-7.14~6.35%)
信頼区間下限>非劣性限界値-10.1%(vs.ナジフロキサシン群)
炎症性皮疹数の減少率の経時推移
各評価時期での炎症性皮疹数の減少率を比較したところ、ゼビアックス群はプラセボ群と比較して治療開始2週後から有意な差が認められた。なお、ゼビアックス群とナジフロキサシン群の減少率は同様の推移を示した。
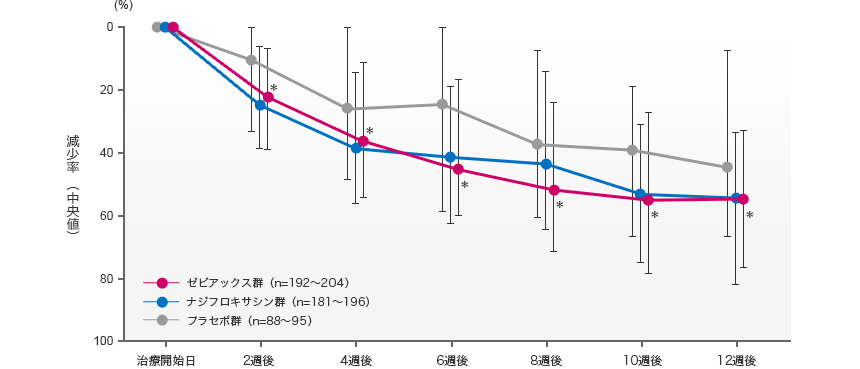
中央値±四分位範囲
- *:vs.プラセボ群との中央値の差の95%信頼区間が0を含まない(ホッジス・レーマン推定値)
C.acnes の生菌数推移:副次評価項目
治療開始日に分離されたC.acnes の検出率は、53.3%(266/499例)であった。
C.acnes の生菌数推移を確認したところ、最終評価時に「菌陰性」または「減少」となった被験者は、ゼビアックス群61.5%(64/104例)、ナジフロキサシン群58.3%(56/96例)およびプラセボ群51.1%(23/45例)であった。
| 投与群 | 菌陰性 または減少 |
菌陰性 | 減少 | 不変 | 増加 |
|---|---|---|---|---|---|
| ゼビアックス群(n=104) | 64例(61.5%) | 50例(48.1%) | 14例(13.5%) | 34例(32.7%) | 6例(5.8%) |
| ナジフロキサシン群(n=96) | 56例(58.3%) | 45例(46.9%) | 11例(11.5%) | 31例(32.3%) | 9例(9.4%) |
| プラセボ群 (n=45) | 23例(51.1%) | 16例(35.6%) | 7例(15.6%) | 16例(35.6%) | 6例(13.3%) |
治療開始日にC.acnes が検出された被験者のうち、最終評価時にも細菌学的検査を実施した被験者および皮疹がすべて消失して細菌学的検査が不可(未実施)であった被験者を対象に集計した。
生菌数が検出限界(10cfu/swab)以下または皮疹がすべて消失した被験者を「菌陰性」、生菌数の減少が102cfu/swab以上を「減少」、生菌数の変動が102cfu/swab未満を「不変」、生菌数の増加が102cfu/swab以上を「増加」と定義してそれぞれの被験者数およびその頻度を算出した。
本試験における副作用
副作用は、ゼビアックス群で204例中1例(0.5%)、ナジフロキサシン群で198例中16例(8.1%)、プラセボ群で97例中6例(6.2%)に認められた。
投与中止に至った副作用はナジフロキサシン群で適用部位刺激感が1例、プラセボ群で適用部位皮膚炎が1例認められた。
また、本試験では死亡および重篤に至る副作用は認められなかった。
| ゼビアックス群 | ナジフロキサシン群 | プラセボ群 | |
|---|---|---|---|
| 安全性解析対象例数 | 204 | 198 | 97 |
| 副作用発現例数(%) | 1 (0.5) | 16 (8.1) | 6 (6.2) |
| 副作用の種類 | 副作用発現例数(%) | ||
|---|---|---|---|
| ゼビアックス群 | ナジフロキサシン群 | プラセボ群 | |
| 一般・全身障害および投与部位の状態 | 0 (0.0) | 12 (6.1) | 4 (4.1) |
| 適用部位皮膚炎 | 0 (0.0) | 0 (0.0) | 1 (1.0) |
| 適用部位紅斑 | 0 (0.0) | 0 (0.0) | 1 (1.0) |
| 適用部位刺激感 | 0 (0.0) | 12 (6.1) | 0 (0.0) |
| 適用部位乾燥 | 0 (0.0) | 1 (0.5) | 3 (3.1) |
| 皮膚および皮下組織障害 | 0 (0.0) | 1 (0.5) | 1 (1.0) |
| 湿疹 | 0 (0.0) | 1 (0.5) | 0 (0.0) |
| 紅斑 | 0 (0.0) | 0 (0.0) | 1 (1.0) |
| 皮膚刺激 | 0 (0.0) | 0 (0.0) | 1 (1.0) |
| 臨床検査 | 1 (0.5) | 3 (1.5) | 1 (1.0) |
| ALT(GPT)増加 | 0 (0.0) | 1 (0.5) | 1 (1.0) |
| AST(GOT)増加 | 0 (0.0) | 1 (0.5) | 1 (1.0) |
| 血中ビリルビン増加 | 1 (0.5) | 1 (0.5) | 0 (0.0) |
| γ-GTP増加 | 0 (0.0) | 1 (0.5) | 0 (0.0) |
| 白血球数増加 | 0 (0.0) | 1 (0.5) | 0 (0.0) |
(MedDRA/J Ver.15.0)
- 5. 効能・効果に関連する注意
- 結節及び嚢腫には、他の適切な治療を行うこと。
- 6. 用法・用量
- 本剤の適量を1日1回、患部に塗布する。なお、ざ瘡に対しては洗顔後、患部に塗布する。
- 7. 用法・用量に関連する注意
-
- <表在性皮膚感染症>
- 7.1 1週間で効果が認められない場合は使用を中止すること。
- <ざ瘡(化膿性炎症を伴うもの)>
- 7.2 4週間で効果が認められない場合は使用を中止すること。
また、炎症性皮疹が消失した場合には継続使用しないこと。
- 8. 重要な基本的注意
- 本剤の使用にあたっては、耐性菌の発現等を防ぐため、疾病の治療上必要な最小限の期間の使用にとどめること。



