ロゼックスの国内第Ⅲ相試験(がん性皮膚潰瘍)
試験デザイン
- 目的
- がん性皮膚潰瘍臭に対するロゼックスゲル0.75%の安全性及び有効性を検討する。
- 試験デザイン
- 多施設共同、非盲検、非対照試験
- 対象
- 感染が示唆されるがん性皮膚潰瘍臭を有する患者21例(においスコア*12以上)
全21例にロゼックスゲル0.75%が投与されたが、1例は潰瘍部位からの滲出液が増加したため、Day7に試験を中止した。 - 方法
- 患部を十分に清浄した後、ロゼックスゲル0.75%を非粘着性のドレッシング材(ガーゼ、シリコンガーゼ、創傷被覆・保護材など)に塗り、皮膚潰瘍部位を覆う。必要に応じて1日1~2回、14日間投与し、1日30gを上限*2とした。
- がん性皮膚潰瘍臭を有する患者21例
- 患部を十分に清浄
0.9%生理食塩水
またはぬるま湯 - ロゼックスゲル0.75%投与
非粘着性のドレッシング材に塗り、皮膚潰瘍部位を覆う。
必要に応じて1日1~2回、14日間投与。
有効性の評価項目
- 主要評価項目
- においの改善率*3
- 副次評価項目
- においスコア、潰瘍部位の臨床所見*4、疼痛*5
- その他の評価項目
- 細菌学的検査*6、被験者のQOL全般改善度*7
安全性の評価項目
有害事象、臨床検査、バイタルサイン、身体所見、尿妊娠検査
*1 においスコア: スクリーニング時、ベースライン(Day0)、Day7、Day14に、皮膚潰瘍のにおいを治験責任(分担)医師、看護師及び被験者が以下の基準により評価した。
| スコア | 定義 |
|---|---|
| 0 | においがない |
| 1 | においはあるが不快ではない(皮膚潰瘍の近傍[約20cm]でわずかに臭う) |
| 2 | 軽度に不快なにおい(皮膚潰瘍の近傍で明らかに臭う) |
| 3 | 中等度に不快なにおい(ベッドサイドで臭う[約1m]) |
| 4 | 非常に不快なにおい(部屋に入ると臭う) |
*2本試験での治験薬の1日投与量は、メトロニダゾール錠(250mg)を経口投与した時の全身曝露量より低い30g(メトロニダゾールとして225mg)を上限とした。
*3 においの改善率: 治験責任(分担)医師によるDay14(又は試験中止時)のにおいスコアが0又は1と評価された被験者の割合とする。また、LOCF法により欠測値を補完した。
*4 潰瘍部位の臨床所見: スクリーニング、ベースライン(Day0)、Day7、Day14に、潰瘍部位の臨床所見を治験責任(分担)医師が評価した。
| スコア | 定義 | 分泌物 (ドレッシング材の交換頻度) |
|---|---|---|
| 0 | なし | 分泌物なし/ 1日1回ドレッシング材交換 |
| 1 | 軽度 | 1日2回ドレッシング材交換 |
| 2 | 中等度 | 1日3回ドレッシング材交換 |
| 3 | 重度 | 1日4回以上ドレッシング材交換/出血 |
*5 疼痛: スクリーニング、ベースライン(Day0)、Day7、Day14に、皮膚潰瘍に関連した過去24時間の痛みについて、被験者が100mmのVASを用いて評価した。(0mm:痛みなし~100mm:最も強い痛み)
*6 細菌学的検査: ベースライン(Day0)の投与前及びDay14(又は試験中止時)のドレッシング材の取換え時に、最も炎症と滲出の強いところ(通常、潰瘍部位の中心)から検体を採取し、細菌の同定及び菌数(半定量)を測定した。
*7 被験者のQOL全般改善度: Day14(又は試験中止時)に被験者及び/又はその家族に対して、被験者における満足度質問票の作成を依頼した。看護師又は医療従事者に対しても、医療従事者における満足度質問票の作成を依頼した。満足度質問票の結果に基づき、治験責任(分担)医師は、投与前と比較した被験者のQOLの改善度を、「著明改善」、「改善」、「やや改善」、「不変」、「悪化」の5分類により評価した。
結果
- 主要評価項目:においの改善率
- 副次評価項目:においスコア
- 副次評価項目:潰瘍部位の臨床所見(参考情報)
- 副次評価項目:疼痛(参考情報)
- その他の評価項目:細菌学的検査
- その他の評価項目:被験者のQOL全般改善度(参考情報)
- 安全性
- 投与状況
主要評価項目:においの改善率
Day14又は試験中止時において、21例中13例が「においがない」、7例が「においはあるが不快ではない」と治験責任(分担)医師によって評価され、においの改善率*は95.2%(20/21例、90%信頼区間:79.3~99.8%、正確法)でした。
*においの改善率:治験責任(分担)医師によって「においがない」又は「においはあるが不快ではない」と評価された割合。また、LOCF法により⽋測値を補完した。
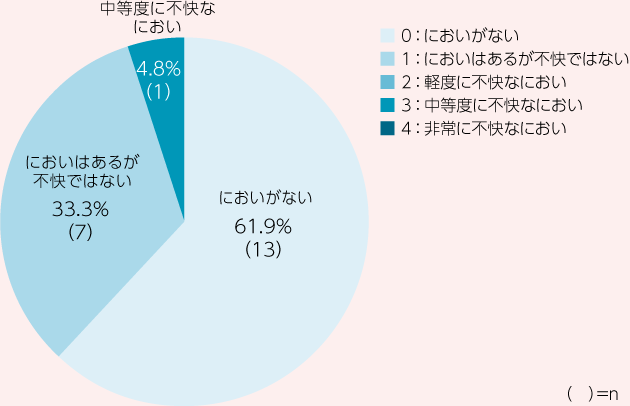
承認時評価資料:Watanabe K. et al.: Support Care Cancer., 24, 2583, 2016より作図
副次評価項目:においスコア
「においがない」または「においはあるが不快ではない」と評価した治験責任(分担)医師の割合は、ベースラインでは0%、Day7では76.2%、Day14では95.0%でした。同様に看護師の評価は、ベースラインでは19.1%、Day7では76.1%、Day14では95.0%でした。被験者の評価は、ベースラインでは42.9%、Day7以降では100.0%でした。
においスコア
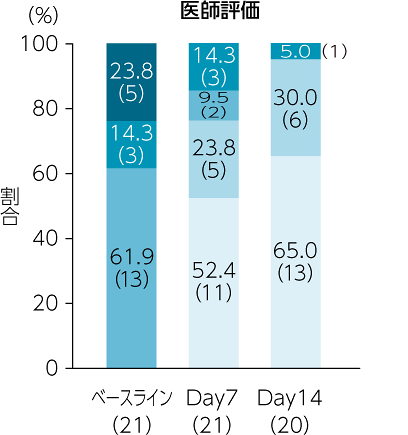
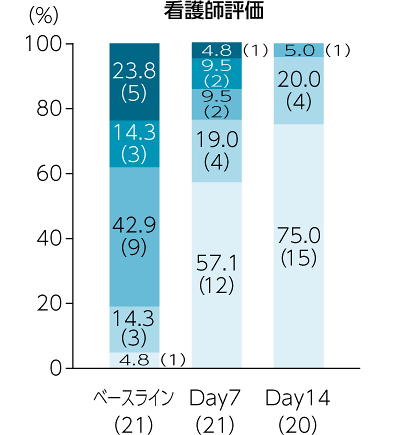
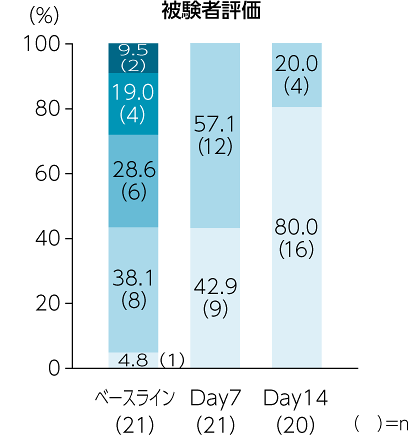

承認時評価資料:Watanabe K. et al.: Support Care Cancer., 24, 2583, 2016一部改変
副次評価項目:潰瘍部位の臨床所見(参考情報)
潰瘍部位の臨床所見のスコアにおいて、「分泌物なし/1日1回ドレッシング材交換」の割合は、ベースラインでは4.8%、Day7では23.8%、Day14では35.0%でした。
分泌物の性状は、ベースラインでは膿性が6例、漿液性+血液を含むが5例及び漿液性が4例でした。Day7及びDay14では漿液性がそれぞれ12例、10例であり、膿性はともに1例でした。
潰瘍部位の臨床所見スコア
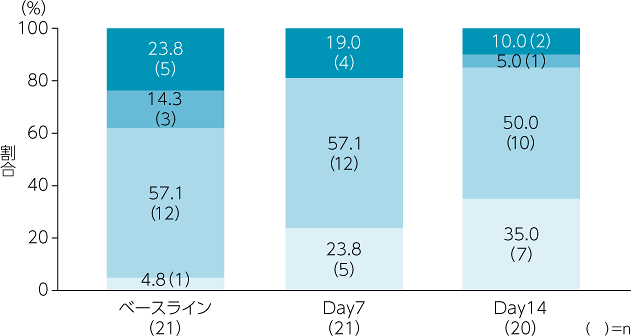

副次評価項目:疼痛(参考情報)
過去24時間の痛みについてVASで評価したところ、VASの平均値±標準偏差は、ベースライン28.3±29.1mm、Day7が25.9±27.1mm、Day14が22.2±25.3mmであり、ベースラインからの変化量の平均値±標準偏差は、Day7が−2.4±21.8mm、Day14が−3.7±23.0mmでした。
その他の評価項目:細菌学的検査
ベースラインでは9例の検体から嫌気性菌が検出されましたが、Day14(又は試験中止時)にはこの9例から嫌気性菌は検出されませんでした。また、Day14(又は試験中止時)に1例の検体から新たに1種類の嫌気性菌が検出されました。
細菌学的検査のシフトテーブル
| ( )=n | Day14(又は試験中止時) | ||
|---|---|---|---|
| 陽性 (n) |
陰性 (n) |
||
| 嫌気性菌 | |||
| ベースライン(Day0) | 陽性(9) 陰性(12) |
0 1 |
9 11 |
| 好気性菌 | |||
| ベースライン(Day0) | 陽性(20) 陰性(1) |
18 1 |
2 0 |
嫌気性菌のプロファイルには大きな変化はありませんでした。
細菌学的検査の要約
| カテゴリ 菌種 |
ベースライン(Day0) n(%) |
Day14(又は試験中止時) n(%) |
|---|---|---|
| 全被験者 | 21 | 21 |
| 好気性菌 | 20(95.2) | 19(90.5) |
| Acinetobacter baumannii complex Aeromonas sp. Bacillus sp. Citrobacter koseri Coagulase(-)staphylococcus Corynebacterium sp. Enterobacter aerogenes Enterobacter cloacae Enterococcus durans Enterococcus faecalis Escherichia coli Gemella morbillorum Klebsiella pneumoniae Proteus mirabilis Pseudomonas aeruginosa Pseudomonas sp. Staphylococcus aureus Streptococcus agalactiae(Group B) β-Streptococcus(Group G) 好気性菌陰性 |
1 1 2 1 2 7 1 2 0 1 1 1 2 2 7 1 9 3 0 1 |
0 0 1 1 1 8 0 0 1 0 2 0 1 3 7 1 8 2 1 2 |
| 嫌気性菌 | 9(42.9) | 1(4.8) |
| Bacteroider caccae Bacteroides fragilis Fusobacterium sp. Peptostrepto. asaccharolyticus Peptostreptococcus magnus Peptostreptococcus micros Peptostreptococcus prevotii Peptostreptococcus sp. Peptostreptococcus tetradius Prevotella intermedia Streptococcus constellatus Streptococcus intermedius 嫌気性菌陰性 |
1 1 1 2 2 2 2 0 2 2 1 1 12 |
0 0 0 0 0 0 0 1 0 0 0 0 20 |
その他の評価項目:被験者のQOL全般改善度(参考情報)
21例中15例(71.4%)で「著明改善」又は「改善」と評価されました。
| カテゴリ | Day14 (又は試験中止時) n(%) |
|---|---|
| 著明改善 改善 やや改善 不変 悪化 |
9(42.9) 6(28.6) 5(23.8) 1(4.8) 0 |
| (n=21) | |
また、満足度質問票の結果では、臭気に対して「かなり効果があった」と回答した者は、被験者及び/又はその家族で6例(28.6%)、看護師又は医療従事者で7例(33.3%)、「非常に効果があった」と回答した者は、それぞれ9例(42.9%)、14例(66.7%)でした。
安全性
安全性解析対象21例中、副作用は2例(9.5%)に認められました。いずれも潰瘍部位からの出血でした。
本試験において死亡例を含む重篤な副作用は認められませんでした。
投与状況
皮膚潰瘍の大きさの平均値は68.6cm2(4~140cm2)、1日の平均投与量は22.6g/日(11~30g/日)、平均投与回数は1.46回/日(0.6~2.0回/日)でした。
皮膚潰瘍の大きさ、治験薬の投与期間及び投与量と回数、ドレッシング交換回数
| 平均値 ± 標準偏差 | 中央値 | 最小値, 最大値 | |
|---|---|---|---|
| 皮膚潰瘍の大きさ(cm2) | 68.6 ± 35.4 | 75.0 | 4, 140 |
| 投与期間(日) | 13.8 ± 1.6 | 14.0 | 8, 17 |
| 総投与量(g) | 311.7 ± 96.8 | 295.0 | 140, 465 |
| 1日投与量(g/日) | 22.6 ± 6.4 | 24.6 | 11, 30 |
| 投与回数(回/日) | 1.46 ± 0.41 | 1.64 | 0.6, 2.0 |
| ドレッシング材の交換回数(回/日) | 2.00 ± 1.31 | 1.64 | 0.6, 5.1 |
(n=21)
【禁忌(次の患者には使用しないこと)】一部抜粋
(3)妊娠3ヵ月以内の婦人[「妊婦、産婦、授乳婦等への使用」の項参照]
【使用上の注意】一部抜粋
2.重要な基本的注意
- (1)本剤の皮膚潰瘍部位への塗布により全身吸収が認められるため、塗布部位が広範囲の場合等には、経口用又は点滴静注用製剤の投与により認められる副作用(末梢神経障害、中枢神経障害、白血球減少、好中球減少など)が、血中濃度の上昇により発現するおそれがある。異常が認められた場合には投与を中止するなど、適切な処置を行うこと。(「薬物動態」の項参照)
- (2)患部を刺激することにより、潰瘍部位の血管が損傷し、出血を招くことがあるので、ガーゼの交換等の処置は十分注意して行うこと。(「適用上の注意」の項参照)
9.その他の注意
本剤の長期の使用経験はないため、本剤を長期に使用する場合には、投与の継続を慎重に判断すること。また本剤の塗布時には、患部の状態を観察し、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。なお、動物にメトロニダゾールを長期経口投与した場合、マウスでは肺腫瘍が、またラットでは乳房腫瘍の発生が報告されているが、ハムスターの生涯投与試験では腫瘍はみられていないとの報告がある。
副作用
国内第Ⅲ相試験における安全性評価対象症例21例において、副作用が2例(9.5%)に認められました。いずれも潰瘍部位からの出血でした。(承認時)
| 安全性評価対象例数 | 21例 |
|---|---|
| 副作用発現例数 | 2例 |
| 副作用発現件数 | 2件 |
| 副作用発現率 | 9.5% |
| 副作用名* | 発現例数 | 発現率 (%) |
重症度 | ||
|---|---|---|---|---|---|
| 軽度 | 中等度 | 重度 | |||
| 良性、悪性及び詳細不明の新生物 (嚢胞及びポリープを含む) 皮膚新生物出血 |
2 | 9.5 | 1 | 1 | 0 |
* MedDRA Ver.15.0で基本語(PT)に読み替え、器官別大分類(SOC)に従って分類したものをMedDRA/J Ver.16を用いて日本語に翻訳
承認時評価資料:Watanabe K. et al.: Support Care Cancer., 24, 2583, 2016
〔利益相反〕本試験に関する費用はガルデルマ株式会社が負担した。また、論文の著者にはガルデルマ株式会社の社員を含む。
海外で実施した第Ⅲ相試験※において、安全性評価対象症例47例(がん性皮膚潰瘍患者20例、非悪性の下腿潰瘍患者27例)において、副作用が4例(8.5%)に認められました。副作用の内訳は、皮膚灼熱感1例、刺痛感1例、潰瘍部位からの出血2例でした。
副作用の発現状況
| 安全性評価対象例数 | 47例 | |
|---|---|---|
| 副作用発現例数 | 4例 | |
| 副作用発現件数 | 4件 | |
| 副作用発現率 | 8.5% | |
| 副作用名* | 発現例数 | 発現率 (%) |
| 皮膚灼熱感 刺痛感 潰瘍部位からの出血 |
1 1 2 |
2.1 2.1 4.3 |
* MedDRA/J Ver.16を用いて日本語に翻訳。完全一致するMedDRA用語(英語)がない場合には、単語の記載順の入れ替え等により最も近い用語(英語)に対応する日本語を採用
※ Finlay, I.G. et al.: J. Pain Symptom Manage., 11, 158, 1996



