原発性腋窩多汗症患者を対象とした国内第Ⅱ/Ⅲ相臨床試験(M606102-02)
本試験は用量設定試験も兼ねるため、一部承認外(グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤)の成績が含まれる。
試験概要
試験名
HDSS3以上の原発性腋窩多汗症患者を対象とした第Ⅱ/Ⅲ相臨床試験(プラセボ対照試験)
目的
原発性腋窩多汗症患者を対象にラピフォートワイプ2.5%およびグリコピロニウムトシル酸塩水和物3.75%ワイプ製剤注)を1日1回28日間投与した際の有効性、安全性および臨床至適濃度をプラセボと比較検討する
試験デザイン
ランダム化、プラセボ対照、二重盲検、並行群間比較、多施設共同試験(検証試験)
対象
原発性腋窩多汗症患者497例
主な選択基準
- HDSSのスコアが3または4の患者
- スコア3︓発汗はほとんど我慢できず、日常生活に頻繁に支障がある
- スコア4︓発汗は我慢できず、日常生活に常に支障がある
- 左右の腋窩ともに5分間の発汗重量が50mg以上であった患者
方法
患者をラピフォートワイプ2.5%群(168例)、グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤注)群(163例)、プラセボ群(166例)にランダムに割り付け、1日1回(夜就寝前)、1枚を用いて左右の腋窩を1回ずつ拭い、28日間塗布した。
有効性の評価項目
主要評価項目
- ①投与開始日と比較した4週後のHDSSが2段階以上改善かつ両腋窩の平均発汗重量が50%以上改善した患者の割合(検証的解析項目)
副次評価項目
- ②投与開始日と比較した4週後のHDSSが2段階以上改善した患者の割合
- ③投与開始日と比較した4週後の両腋窩の平均発汗重量が50%以上改善した患者の割合
- ④4週後の両腋窩の平均発汗重量(対数変換値)
- ⑤ベースラインと比較した4週後の平均ASDDまたは平均ASDD-C Q2が4段階以上改善した患者の割合
その他の評価項目
- ⑥DLQIおよびCDLQIスコアの変化量と4段階以上変化した患者の割合
- ⑦ベースラインと比較した平均ASDDまたは平均ASDD-C Q2が4段階以上改善した患者の割合の経時推移 など
安全性の評価項目
有害事象、臨床検査値、バイタルサイン
解析計画
主要評価項目および副次評価項目は最大の解析対象集団(Full analysis set︓ FAS)を対象に解析した。また、主要評価項目および副次評価項目において欠測はWorst observation carried forward(WOCF)で補完した。
主要評価項目
①はピアソンのカイ二乗検定で群間比較した。多群比較による多重性を調整するため、グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤注)群とプラセボ群の比較が両側5%水準で有意となった場合のみ、ラピフォートワイプ2.5%群とプラセボ群を比較した。
副次評価項目
②および③は、ピアソンのカイ二乗検定で群間比較した。④は、各Visitの両腋窩の平均発汗重量(対数変換値、底は2)を応答変数とし、Visit間の相関構造にUnstructured(無構造)を仮定した混合効果モデルを用いて解析した。⑤は、ベースラインの平均ASDDおよび平均ASDD-C Q2スコアが4以上の患者を対象に、ASDDとASDD-C Q2スコアをプールし、ピアソンのカイ二乗検定により群間比較した。
いずれの副次評価項目も、多重性未調整とした。
その他評価項目の解析
投与群およびVisitごとに、連続変数は要約統計量を、離散変数は例数および割合を求めた。⑥はFASを対象に、⑦はFASのうちベースラインのDLQIおよびCDLQIスコアが4以上の患者を対象とした。
注)グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤群は承認外用量のため、有効性に関する結果は未記載。
解析対象症例
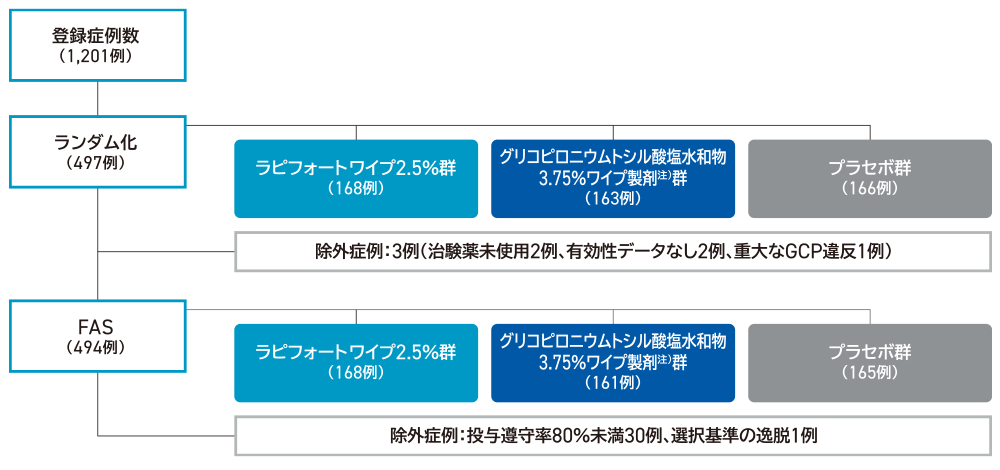
患者背景(FAS)
| ラピフォートワイプ 2.5%群 (N=168) |
グリコピロニウムトシル酸塩水和物 3.75%ワイプ製剤注)群 (N=161) |
プラセボ群 (N=165) |
|
|---|---|---|---|
| 性別 n(%) | |||
| 男 | 71(42.3) | 61(37.9) | 71(43.0) |
| 女 | 97(57.7) | 100(62.1) | 94(57.0) |
| 年齢(歳) | |||
| 平均値(SD) | 38.3(10.8) | 38.6(12.2) | 37.7(10.9) |
| 中央値(範囲) | 39.0(16-64) | 40.0(17-71) | 39.0(14-71) |
| ベースラインのHDSS | |||
| 3:発汗はほとんど我慢できず、 日常生活に頻繁に支障がある |
128(76.2) | 122(75.8) | 126(76.4) |
| 4:発汗は我慢できず、 日常生活に常に支障がある |
40(23.8) | 39(24.2) | 39(23.6) |
| ベースラインのASDD/ASDD-C Q2 | |||
| 平均値(SD) | 6.05(1.64) | 5.95(1.73) | 5.90(1.71) |
| 中央値(範囲) | 6.15(2.0-9.7) | 6.14(2.4-10.0) | 6.17(1.6-10.0) |
| ベースラインのDLQI | |||
| 平均値(SD) | 7.0(5.5) | 7.9(5.7) | 6.7(5.2) |
| 中央値(範囲) | 6.0(0-26) | 8.0(0-25) | 6.0(0-20) |
| ベースラインの発汗重量(mg) | |||
| 平均値(SD) | 143.60(99.01) | 137.32(95.05) | 133.48(92.68) |
| 中央値(範囲) | 102.53 (51.60-583.20) |
106.70 (51.05-643.25) |
108.35 (50.20-586.40) |
注)グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤群は承認外用量のため、有効性に関する結果は未記載。
有効性
主要評価項目:
投与開始日と比較した4週後のHDSSが2段階以上改善かつ両腋窩の平均発汗重量が50%以上改善した患者の割合(検証的解析結果)
投与4週後の時点で改善した患者の割合は、ラピフォートワイプ2.5%群41.1%(69/168例)、プラセボ群16.4%(27/165例)で、両群間に統計学的有意差が認められ(p<0.0001、ピアソンのカイ二乗検定)、ラピフォートワイプ2.5%のプラセボに対する優越性が検証された。
両群間の有意差は、投与1週後から認められた(p=0.0003、名目上のp値、ピアソンのカイ二乗検定)。
- 1~3週後は多重性を未調整
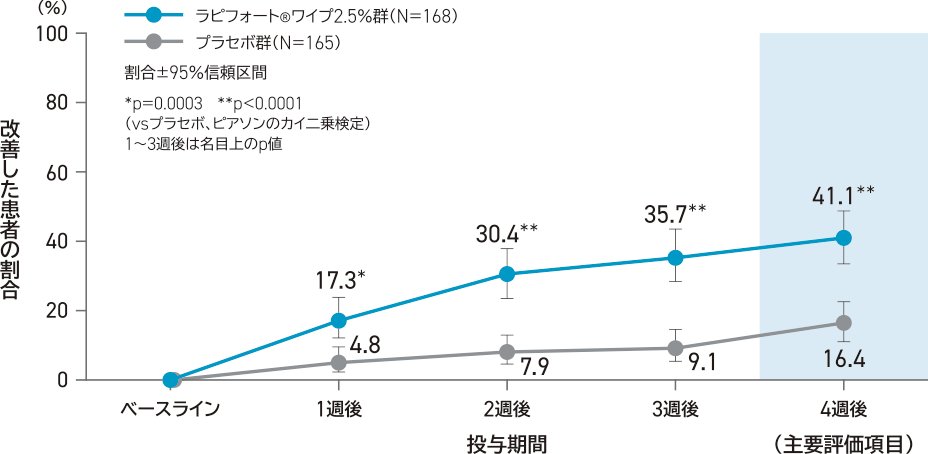
副次評価項目:
投与開始日と比較した4週後のHDSSが2段階以上改善した患者の割合
投与4週後の時点で改善した患者の割合は、ラピフォートワイプ2.5%群44.0%(74/168例)、プラセボ群20.6%(34/165例)で、ラピフォートワイプ2.5%群はプラセボ群と比較して統計学的に有意に高かった(p<0.0001、名目上のp値、ピアソンのカイ二乗検定)。
- 多重性は未調整
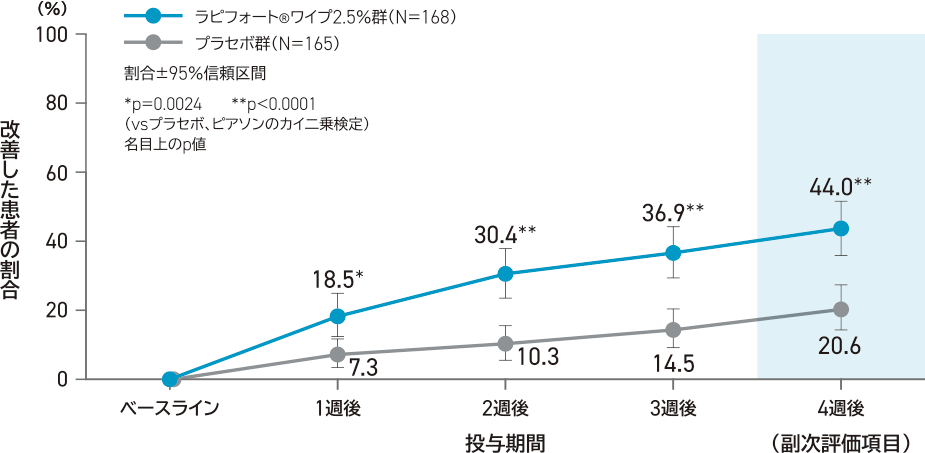
副次評価項目:
投与開始日と比較した4週後の両腋窩の平均発汗重量が50%以上改善した患者の割合
投与4週後の時点で改善した患者の割合は、ラピフォートワイプ2.5%群89.9%(151/168例)、プラセボ群70.3%(116/165例)であり、ラピフォートワイプ2.5%群はプラセボ群と比較して統計学的に有意に高かった(p<0.0001、名目上のp値、ピアソンのカイ二乗検定)。
- 多重性は未調整
副次評価項目:
4週後の両腋窩の平均発汗重量(対数変換値)
投与4週後の両腋窩の平均発汗重量の最小二乗平均値は、ラピフォートワイプ2.5%群3.44mg、プラセボ群4.64mgであり、ラピフォートワイプ2.5%群はプラセボ群と比較して統計学的に有意に低かった(p<0.0001、名目上のp値、混合効果モデル)。
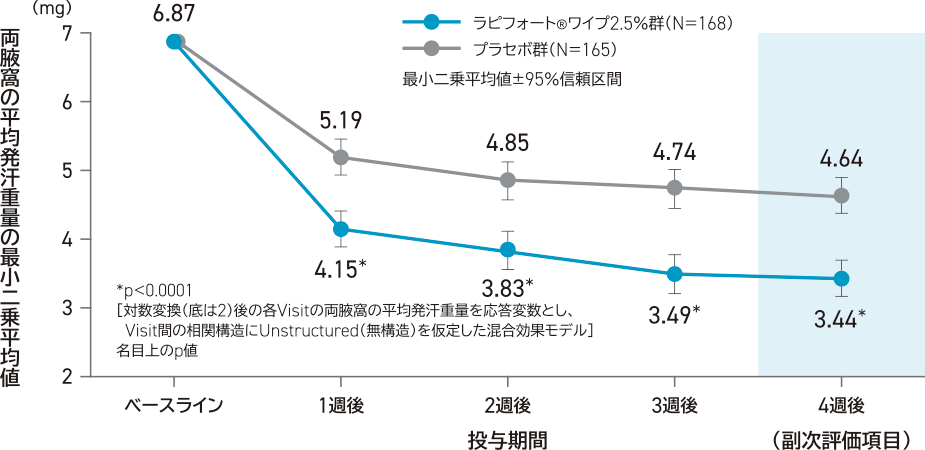
- 多重性は未調整
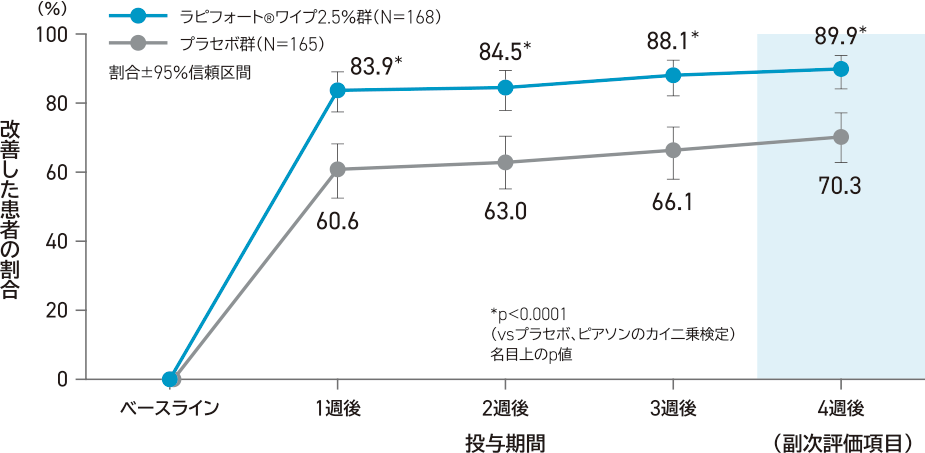
副次評価項目:
ベースラインと比較した4週後の平均ASDDまたは平均ASDD-C Q2が4段階以上改善した患者の割合
ラピフォートワイプ2.5%群36.2%(54/149例)、プラセボ群11.2%(16/143例)であり、ラピフォートワイプ2.5%群はプラセボ群と比較して統計学的に有意に高かった(p<0.0001、名目上のp値、ピアソンのカイ二乗検定)。
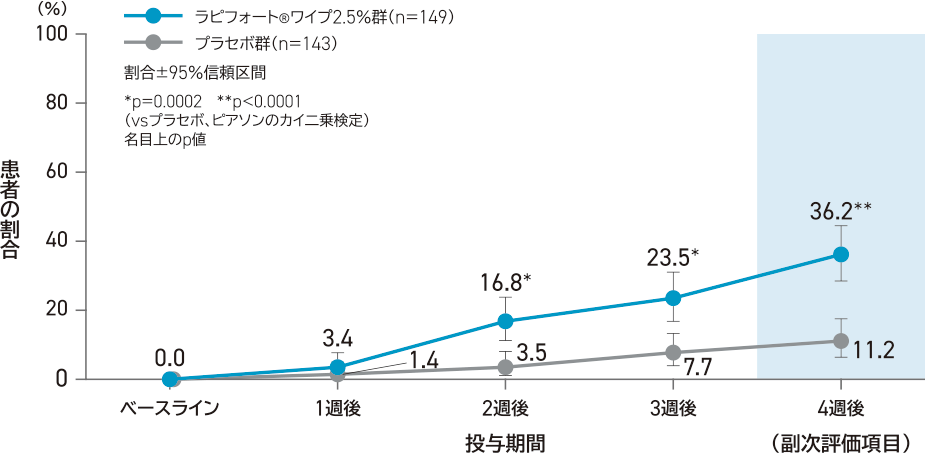
- 対象はベースラインの平均ASDDまたは平均ASDD-C Q2が4以上の患者
- 多重性は未調整
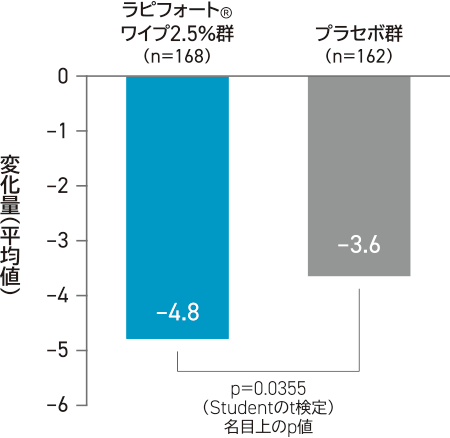
その他の評価項目:
DLQIおよびCDLQIスコアの変化量と4段階以上変化した患者の割合
投与4週後のDLQI合計スコアのベースラインからの変化量は、ラピフォートワイプ2.5%群-4.8、プラセボ群-3.6であった。4週後にDLQIスコアがベースラインから4段階以上変化した患者の割合は、ラピフォートワイプ2.5%群76.4%(94/123例)、プラセボ群69.9%(79/113例)であった。
投与4週間後のDLQI合計スコアの
ベースラインからの変化量
投与4週間後のDLQI合計スコアが
ベースラインから4段階以上変化した患者の割合
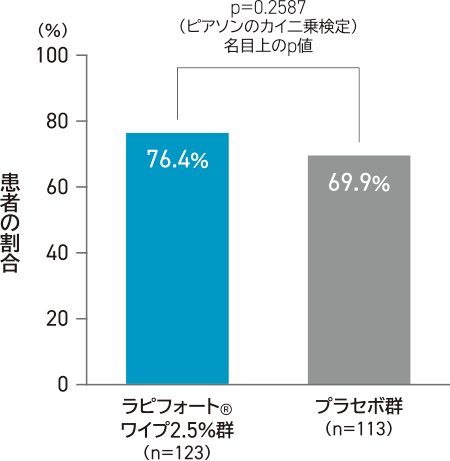
- 対象はベースラインのDLQI合計スコアが4以上の患者
注)グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤群は承認外用量のため、有効性に関する結果は未記載。
安全性
副作用
副作用の発現頻度は、ラピフォートワイプ2.5%群が15.5%(26/168例)、グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤注)群が24.2%(39/161例)、プラセボ群が13.3%(22/165例)であった。
主な副作用は、ラピフォートワイプ2.5%群で散瞳3.6%(6/168例)、排尿困難3.0%(5/168例)、羞明2.4%(4/168例)、グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤注)群で、羞明6.2%(10/161例)、口渇5.0%(8/161例)、散瞳および排尿困難3.7%(6/161例)、頻尿3.1% (5/161例)、プラセボ群で口渇および頻尿3.0%(5/165例)であった。
投与中止に至った副作用は、ラピフォートワイプ2.5%群、プラセボ群では認められず、グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤注)群で3例(排尿困難および口渇各3例、便秘2例、ドライアイおよび口腔咽頭痛各1例)認められた。
本試験において死亡例を含む重篤な副作用はなかった。
比較的よくみられた副作用(いずれかの投与群で副作用の発現割合が2%以上であった副作用)
(安全性解析対象集団)
| 基本語 | ラピフォートワイプ 2.5%群 (N=168) |
グリコピロニウムトシル酸塩水和物 3.75%ワイプ製剤注)群 (N=161) |
プラセボ群 (N=165) |
|---|---|---|---|
| 眼障害 | |||
| 散瞳 | 6(3.6) | 6(3.7) | 1(0.6) |
| 羞明 | 4(2.4) | 10(6.2) | 1(0.6) |
| 一般・全身障害および投与部位の状態 | |||
| 口渇 | 3(1.8) | 8(5.0) | 5(3.0) |
| 腎および尿路障害 | |||
| 排尿困難 | 5(3.0) | 6(3.7) | 3(1.8) |
| 頻尿 | 2(1.2) | 5(3.1) | 5(3.0) |
n (%) 1件のイベントが複数回発生した場合、1回だけカウントすることとした。
MedDRA/J version 22.0
注)グリコピロニウムトシル酸塩水和物3.75%ワイプ製剤群は承認外用量のため、有効性に関する結果は未記載。
- 6. 用法・用量
- 1日1回、1包に封入されている不織布1枚を用いて薬液を両腋窩に塗布する。
社内資料 : 原発性腋窩多汗症患者を対象とした第Ⅱ/Ⅲ相試験(プラセボ対照試験)(承認時評価資料)[CTD2.7.6.5]



