小児アトピー性皮膚炎患者を対象としたプロトピック軟膏0.03%と軟膏基剤の第Ⅲ相二重盲検比較試験
試験概要
対象
2歳以上16歳未満の小児アトピー性皮膚炎患者のうち、以下の基準を満たす症例
・中等症~重症[Rajka & Langelandの基準を参考]のアトピー性皮膚炎[Hanifin & Rajkaの基準を参考]と診断された患者
・患者の体重区分ごとに定めた試験薬の1回塗布量の上限ですべての皮疹に塗布可能な患者
・躯幹又は四肢に中等度以上(試験薬の有効性を評価できる程度)の皮疹が存在する患者
有効性評価対象例:プロトピック軟膏0.03%群72例、軟膏基剤群71例
安全性評価対象例:プロトピック軟膏0.03%群73例、軟膏基剤群71例
方法
プロトピック軟膏0.03%又は軟膏基剤を1日2回(およそ12時間間隔)単純塗布し、外用期間は3週間とした。1回塗布量の上限(被験者の体重10kgあたり1gを超えない用量、1回最大5g)を設定した。
■1回塗布量の上限
| 体重区分 | 1回塗布量の上限 |
|---|---|
| 20kg未満 | 1g |
| 20kg以上30kg未満 | 2g |
| 30kg以上40kg未満 | 3g |
| 40kg以上50kg未満 | 4g |
| 50kg以上 | 5g |
主要評価項目
主有効性観察・評価部位における最終時改善度
副次評価項目
・主有効性観察・評価部位における観察時期別改善度
・主有効性観察・評価部位における皮膚症状スコアの合計の変化及び各皮膚症状スコアの変化
・試験薬塗布部位における皮膚症状スコアの合計の変化及び各皮膚症状スコアの変化
・試験薬塗布部位における皮疹面積の変化
・そう痒の程度の変化
・試験薬塗布部位全体における全般改善度
・本試験における有害事象及び副作用
主有効性観察・評価部位
試験薬塗布部位のうち躯幹又は四肢に中等度以上(試験薬の有効性を評価できる程度)の典型的な皮疹が存在する一部位(100cm2程度を目安とする)を主有効性観察・評価部位とした。ただし、手(手首から先)、足底は含めないこととした。
観察・評価日
塗布開始日:塗布開始第1日
1週後:塗布開始5~11日後
2週後:塗布開始12~18日後
3週後:塗布開始19~25日後又は中止日
最終時改善度(主要評価項目)
プロトピック軟膏0.03%群の最終時の改善率(「著明改善」以上)は66.7%であり、軟膏基剤群と比べて有意に高かった。
<主有効性観察・評価部位>
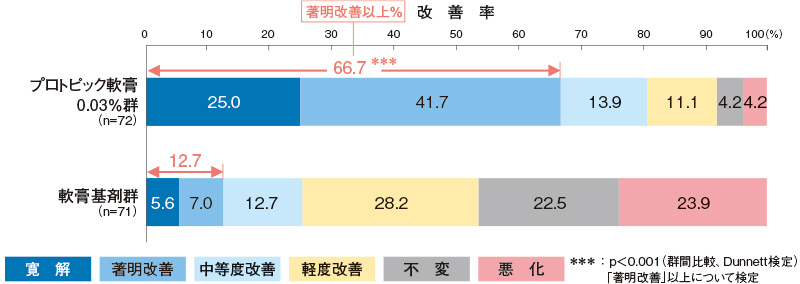
評価基準:皮膚症状(紅斑・浮腫、丘疹・漿液性丘疹・小水疱、苔癬化・痒疹結節)の程度を5段階(高度:4、中等度:3、軽度:2、軽微:1、なし:0)でスコア化し、塗布開始3週後(又は中止日)の開始日に対する皮膚症状スコアの合計の変化率を6段階(寛解:100%、著明改善:67~99%、中等度改善:34~66%、軽度改善:1~33%、不変:0%、悪化:<0%)で評価した。
時期別改善度(副次評価項目)
プロトピック軟膏0.03%群の時期別の改善率(「著明改善」以上)は、1週後26.4%、2週後56.3%、3週後76.2%であり、いずれにおいても軟膏基剤群と比べて有意に高かった。
<主有効性観察・評価部位>
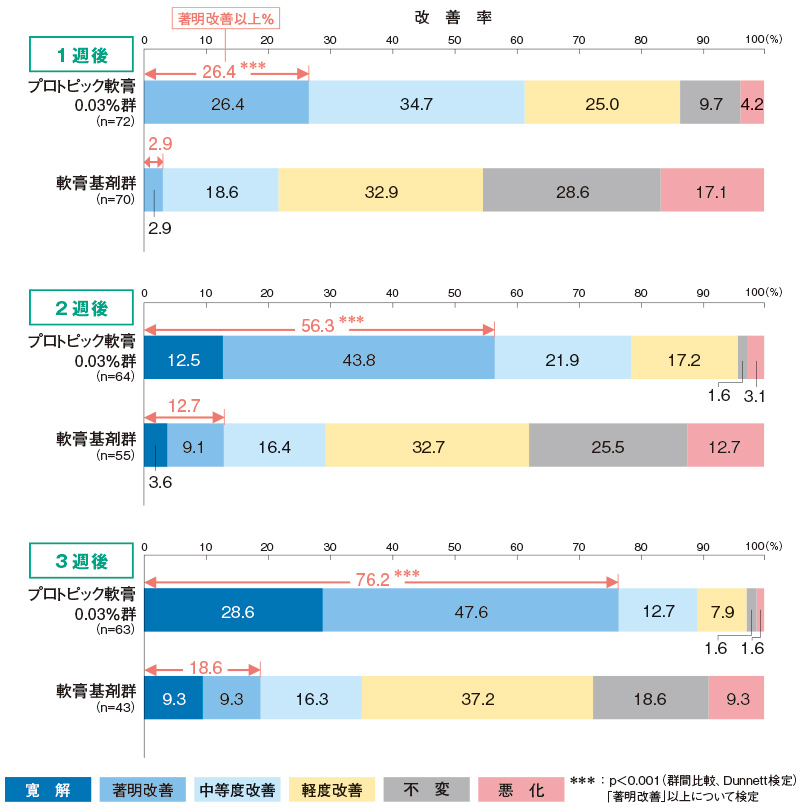
評価基準:皮膚症状(紅斑・浮腫、丘疹・漿液性丘疹・小水疱、苔癬化・痒疹結節)の程度を5段階(高度:4、中等度:3、軽度:2、軽微:1、なし:0)でスコア化し、塗布開始1週後、2週後及び3週後(又は中止日)の開始日に対する皮膚症状スコアの合計の変化率を6段階(寛解:100%、著明改善:67~99%、中等度改善:34~66%、軽度改善:1~33%、不変:0%、悪化:<0%)で評価した。
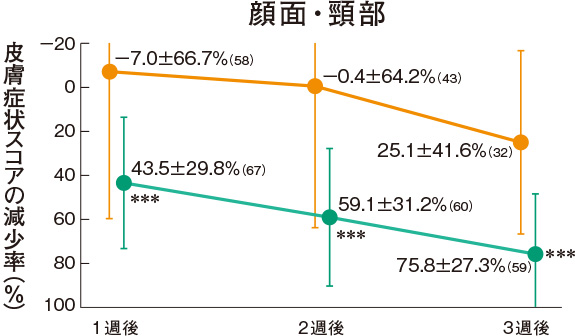
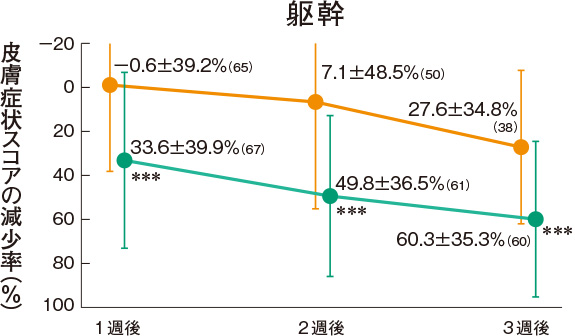
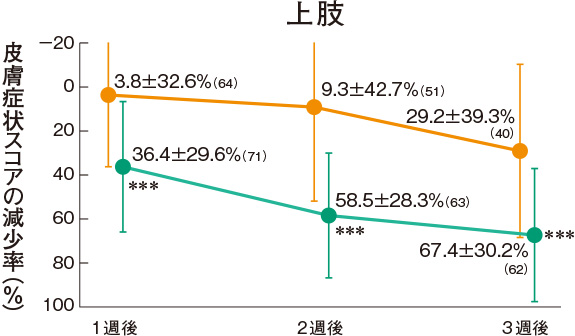
皮膚症状スコアの推移(副次評価項目)
プロトピック軟膏0.03%群は、各部位の皮膚症状に対していずれの時期においても改善効果を示した。
<主有効性観察・評価部位>
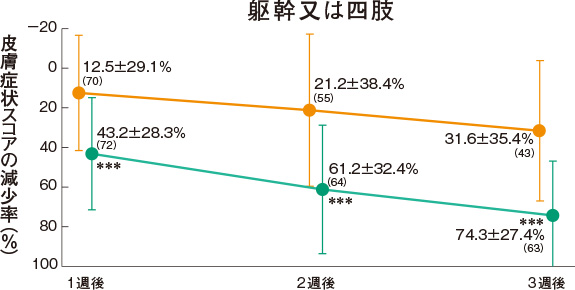
<試験薬塗布部位(すべての皮疹部位)>
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
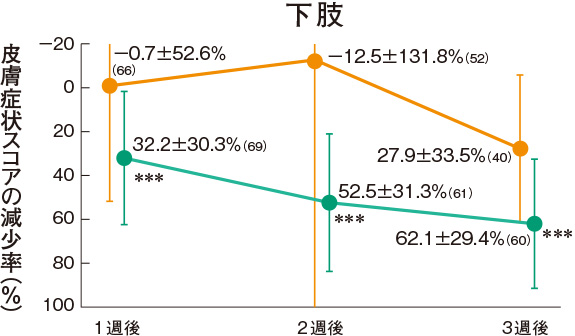

評価基準:皮膚症状(紅斑・浮腫、丘疹・漿液性丘疹・小水疱、苔癬化・痒疹結節)の程度を5段階(高度:4、中等度:3、軽度:2、軽微:1、なし:0)でスコア化し、開始日に対するスコアの合計の減少率を求めた。
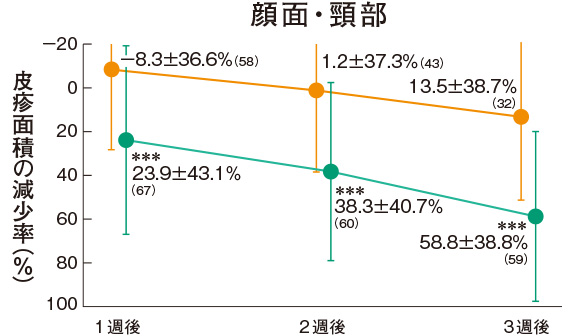
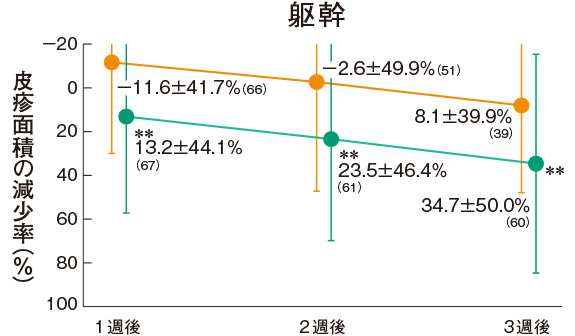
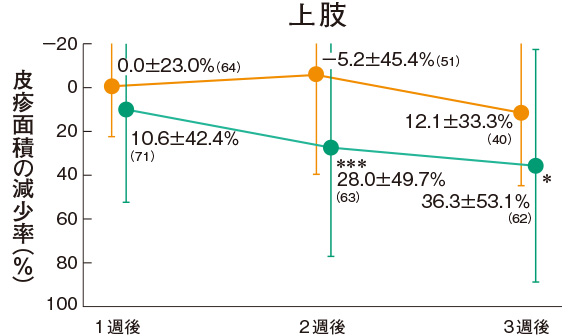
皮疹面積の推移(副次評価項目)
プロトピック軟膏0.03%群の各部位の皮疹面積の減少率は、上肢の1週後を除くすべての時期で軟膏基剤群に比べて有意に大きかった。
<試験薬塗布部位(すべての皮疹部位)>
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
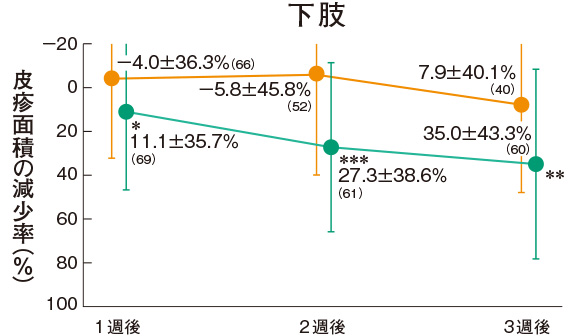

評価基準:皮疹面積の割合を4段階(2/3 以上:3、1/3 以上2/3 未満:2、1/3 未満:1、なし:0)でスコア化し、開始日に対するスコアの合計の減少率を求めた。
本試験における副作用
プロトピック軟膏0.03%群の副作用は、36/73例(49.3%)に認められた。被験部位では、皮膚刺激感(刺激感、ヒリヒリ感、ほてり感、熱感、そう痒感等)が33例、皮膚感染症(伝染性膿痂疹、毛包炎(毛嚢炎)、伝染性軟属腫)が7例、その他の随伴症状(ざ瘡、尋常性ざ瘡)が3例に認められた。被験部位以外では、単純疱疹及び麦粒腫が各1例に認められた。
軟膏基剤群の副作用は、16/71例(22.5%)に認められた。被験部位では、皮膚刺激感(刺激感、ヒリヒリ感、ほてり感、熱感、そう痒感等)が10例、皮膚感染症(伝染性膿痂疹、毛包炎(毛嚢炎))が3例に認められた。被験部位以外では、頸部リンパ節炎が1例に認められた。また、臨床検査値異常変動(白血球減少等)が2例に認められた。軟膏基剤群の有害事象による中止例は2例(ヒリヒリ感・ほてり感、伝染性膿痂疹)に認められた。
本試験において死亡例を含む重篤な有害事象は認められなかった。
- 5. 効能・効果に関連する注意
- ステロイド外用剤等の既存療法では効果が不十分又は副作用によりこれらの投与ができないなど、本剤による治療がより適切と考えられる場合に使用する。
- 6. 用法・用量
- 通常、小児には1日1~2回、適量を患部に塗布する。なお、1回あたりの塗布量は5gまでとするが、年齢により適宜減量する。
- 7.1
- 1回あたりの最大塗布量については、次の表を目安にする。
| 年齢(体重)区分 | 1回塗布量の上限 |
|---|---|
| 2歳〜5歳(20kg未満) | 1g |
| 6歳〜12歳(20kg以上50kg未満) | 2g〜4g |
| 13歳以上(50kg以上) | 5g |
参考:臨床試験時の用量
- 7.2
- 皮疹の増悪期には角質層のバリア機能が低下し、血中濃度が高くなる可能性があるので、本剤の使用にもかかわらず2週間以内に皮疹の改善が認められない場合には使用を中止すること。また、皮疹の悪化をみる場合にも使用を中止すること。
- 7.3
- 症状改善により本剤塗布の必要がなくなった場合は、速やかに塗布を中止し、漫然と長期にわたって使用しないこと。
- 7.4
- 1日2回塗布する場合はおよそ12時間間隔で塗布すること。
- 8.1
- 重度の皮疹もしくは塗布面積が広範囲にわたる場合は、血中濃度が高くなる可能性があるので、本剤使用開始の2~4週間後に1回、その後は必要に応じて適宜腎機能検査を行い、異常が認められた場合には、直ちに使用を中止し、適切な処置を行うこと。
大槻マミ太郎ほか:臨床医薬19(6), 569, 2003 [G3051532](承認時評価資料)



