プロトピック軟膏0.1%の顔面・頸部のアトピー性皮膚炎に対する0.1%アルクロメタゾンプロピオン酸エステル軟膏との第Ⅲ相無作為化群間比較試験
試験概要
対象
顔面・頸部に中等度以上の病変を有する16歳以上のアトピー性皮膚炎患者[Hanifin & Rajkaの基準を参考]
有効性評価対象例:プロトピック軟膏0.1%群73例、0.1%アルクロメタゾンプロピオン酸エステル軟膏群70例
安全性評価対象例:プロトピック軟膏0.1%群75例、0.1%アルクロメタゾンプロピオン酸エステル軟膏群76例
方法
プロトピック軟膏0.1%又は0.1%アルクロメタゾンプロピオン酸エステル軟膏を1日2回、適量を単純塗布、外用期間は1週間とした。ただし、試験開始3日後の観察日に「治癒」と判定され、それ以上の治療の必要を認めない場合は、外用を終了してもよいこととした。
アトピー性皮膚炎に直接効果が期待される薬剤の全身投与やPUVA療法等、及び顔面・頸部への他の外用薬の併用は禁止した。
主要評価項目
最終全般改善度及び被験部位の概括安全度
観察・評価日
試験開始前:外用開始日
3日後:外用開始2~4日後
1週後:外用開始5~9日後
最終:最終観察・評価日
最終全般改善度(主要評価項目)
最終観察・評価日のプロトピック軟膏0.1%群の「著明改善」以上の改善率は86.3%であり、0.1%アルクロメタゾンプロピオン酸エステル軟膏群の35.7%に比べ、有意に高い改善効果を示した。
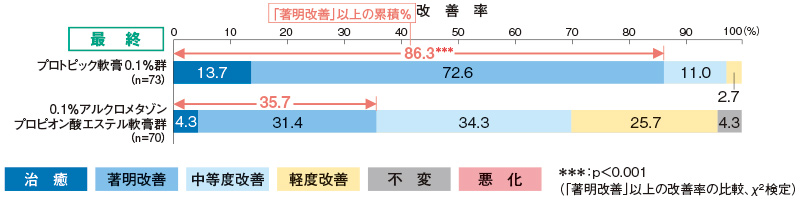
評価基準:試験開始後の最終観察・評価日に、各皮膚所見の推移を総合的に考慮し、試験開始前と比較した全般改善度を6段階(「治癒」「著明改善」「中等度改善」「軽度改善」「不変」「悪化」)で判定した。
時期別全般改善度
プロトピック軟膏0.1%群の時期別改善率(「著明改善」以上)は、3日後36.5%、1週後85.9%であり、いずれにおいても0.1%アルクロメタゾンプロピオン酸エステル軟膏群に比べて有意に高い改善効果を示した。
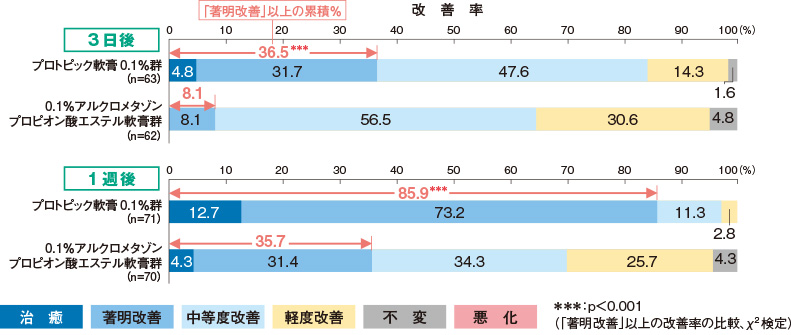
評価基準:試験開始後の各観察・評価日に、各皮膚所見の推移を総合的に考慮し、試験開始前と比較した全般改善度を6段階(「治癒」「著明改善」「中等度改善」「軽度改善」「不変」「悪化」)で判定した。
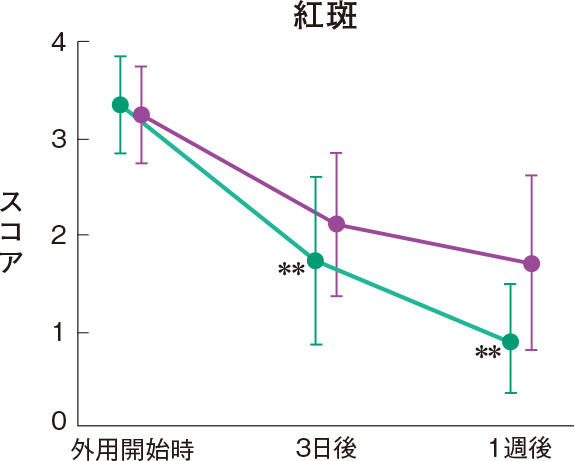
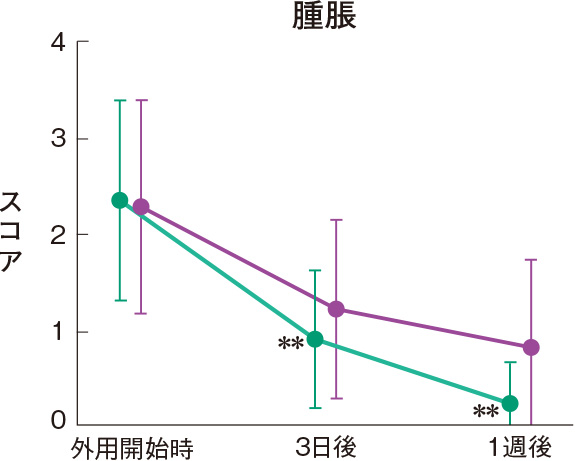
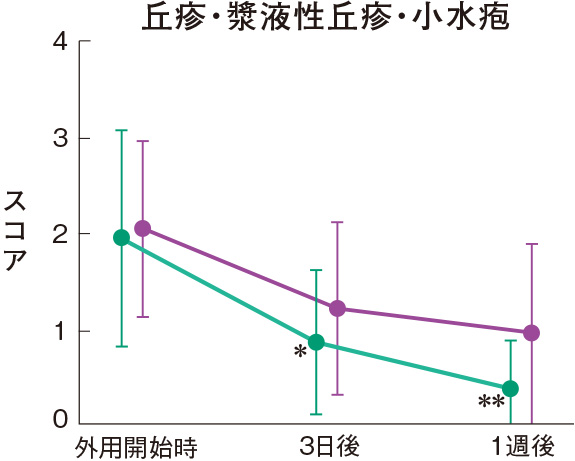
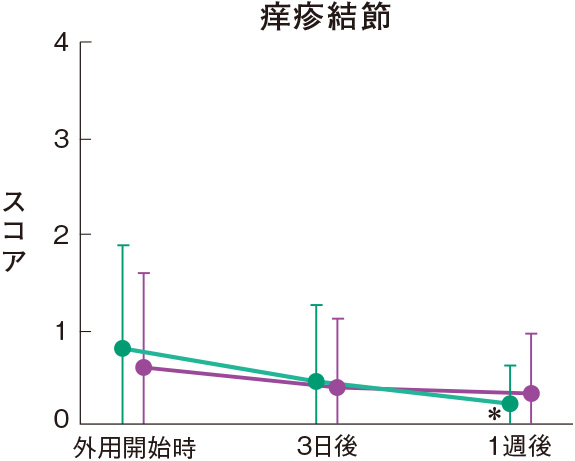
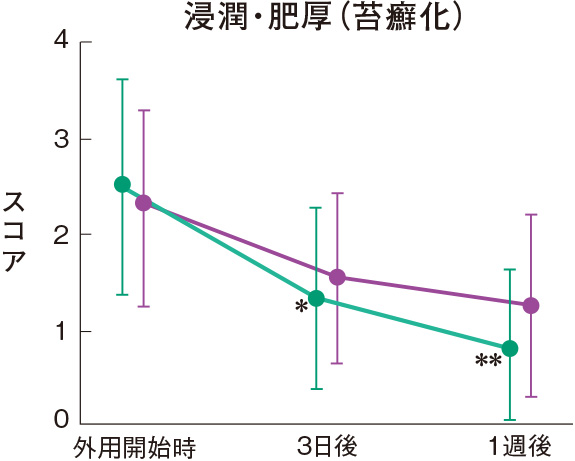
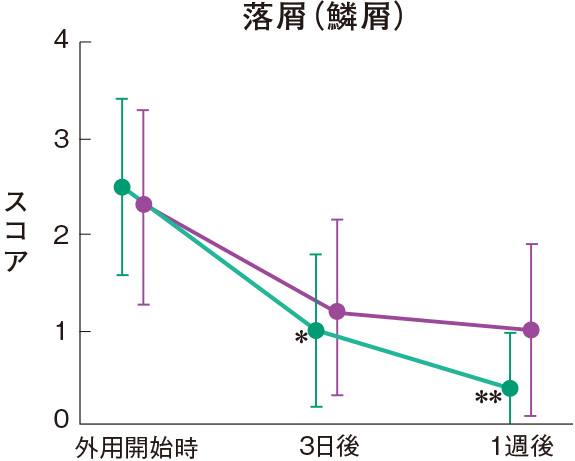
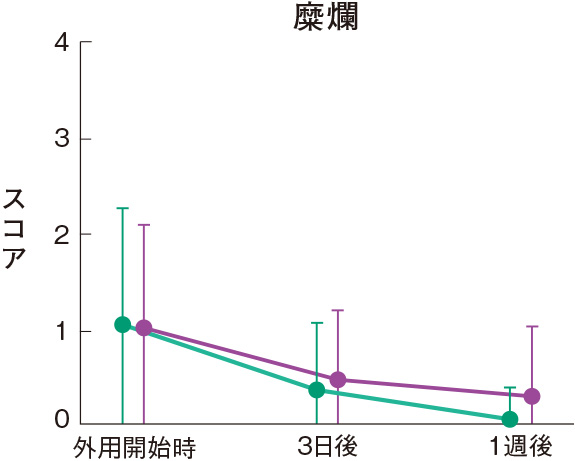
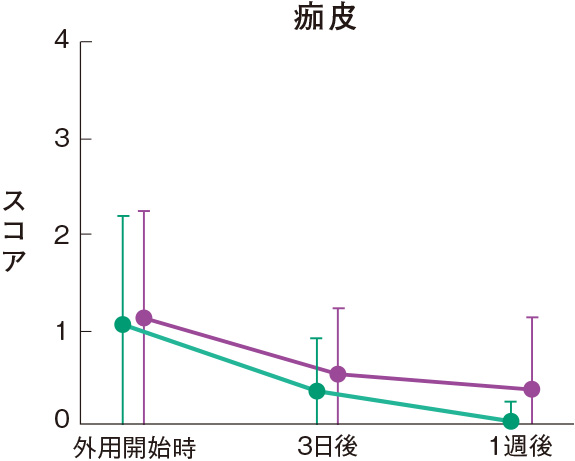
症状別皮膚所見の推移
群間の比較では、糜爛、痂皮を除いたすべての皮膚所見で、プロトピック軟膏0.1%群は0.1%アルクロメタゾンプロピオン酸エステル軟膏群に比べて有意にスコアが低下した。
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
-
記事/インライン画像
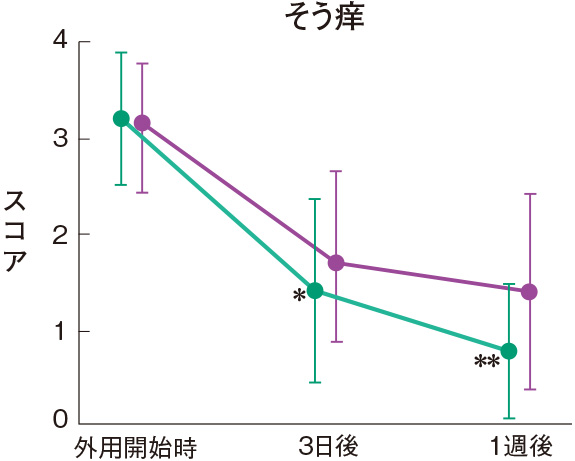

評価基準:各皮膚所見を5段階(4:高度、3:中等度、2:軽度、1:軽微、0:なし)で評価し、スコア化した。
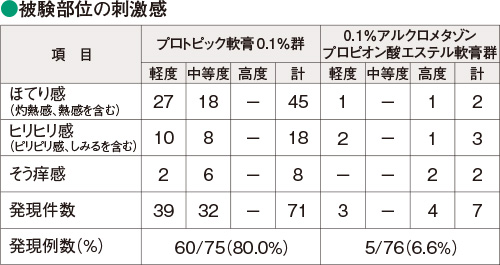
本試験における副作用
プロトピック軟膏0.1%群で認められた被験部位の副作用は、刺激感(ほてり感、ヒリヒリ感、そう痒感など)が60/75例(80.0%)、その他の随伴症状としてざ瘡が3/75例(4.0%)であった。また、被験部位以外の随伴症状として、頭重感が1/75例(1.3%)に認められた。
0.1%アルクロメタゾンプロピオン酸エステル軟膏群で認められた被験部位の副作用は、刺激感が5/76例(6.6%)、その他の随伴症状としてざ瘡が1/76例(1.3%)、感染症として毛嚢炎が1/76例(1.3%)であった。
なお、刺激感は両群ともに塗布後一過性のものがほとんどで、全例が外用期間中あるいは外用の終了とともに発現しなくなった。
本試験において死亡例を含む重篤な副作用は認められなかった。
- 5. 効能・効果に関連する注意
- ステロイド外用剤等の既存療法では効果が不十分又は副作用によりこれらの投与ができないなど、本剤による治療がより適切と考えられる場合に使用する。
- 6. 用法・用量
- 通常、成人には1日1~2回、適量を患部に塗布する。なお、1回あたりの塗布量は5gまでとする。
- 7.3
- 1日2回塗布する場合はおよそ12時間間隔で塗布すること。
FK506軟膏研究会:皮膚科紀要92(3), 277, 1997 [G3050956](承認時評価資料)



