オキサロール軟膏の掌蹠膿疱症患者を対象とした国内第Ⅲ相臨床試験(軟膏の比較臨床試験)
試験概要
目的
オキサロール軟膏25μg/gの掌蹠膿疱症に対する有効性、安全性の検討
対象
20歳以上80歳未満の中等症以上の掌蹠膿疱症患者
評価例数
軟膏94例、プラセボ93例(有効性)、軟膏95例(安全性)
投与方法
オキサロール軟膏25μg/g又はプラセボを被験部位に1日2回、適量(1日最高量10g)を8週間単純塗擦
評価項目
主要評価項目
最終評価時(8週後又は中止日)の皮膚所見合計スコアの変化量
副次評価項目
皮膚所見の改善度、最終評価時(8週後又は中止日)の皮膚所見各項目スコアの変化量
解析計画
主要な解析は共分散分析、Wilcoxon順位和検定とし、有意水準は両側5%とした
主要評価項目
皮膚所見合計スコアの推移
オキサロール軟膏の最終時の皮膚所見合計スコア変化量は-3.7であり、プラセボの-1.9に比し、スコアの有意な低下が認められた。
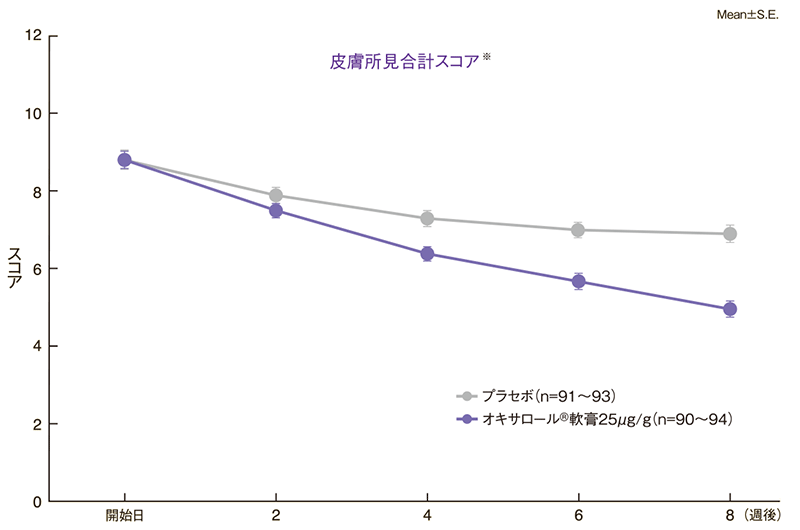
※各皮膚所見(紅斑、膿疱・小水疱、角化・鱗屑)スコアの合計値
評価基準:紅斑、膿疱・小水疱、角化・鱗屑の各皮膚所見についてそれぞれ「0:なし」「1:軽微」「2:軽度」「3:中等度」「4:高度」の5段階のスコアで評価
皮膚所見合計スコアの変化量
| 皮膚所見合計スコア平均値 | 皮膚所見 合計スコア変化量* (Mean±S.D.) |
変化量の群間比較 p値(検定法:共分散分析) |
||
|---|---|---|---|---|
| 開始日 | 最終時(8週後又は中止日) | |||
| オキサロール軟膏25μg/g(n=94) | 8.7 | 5.0 | ‐3.7±2.1 | p<0.0001 |
| プラセボ(n=93) | 8.8 | 6.9 | ‐1.9±1.9 | |
*開始日と最終時(8週後又は中止日)の変化量
副次評価項目
皮膚所見別の推移
紅斑、膿疱・小水疱、角化・鱗屑の各皮膚所見に改善が認められた。
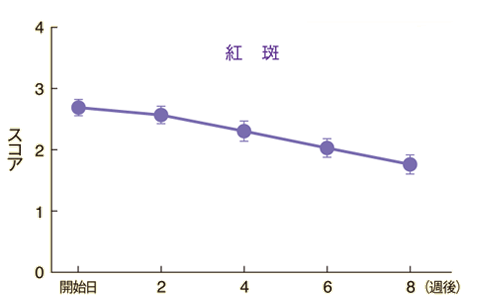
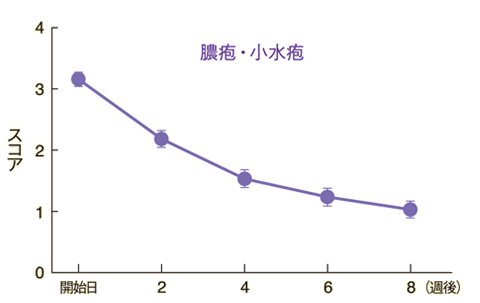
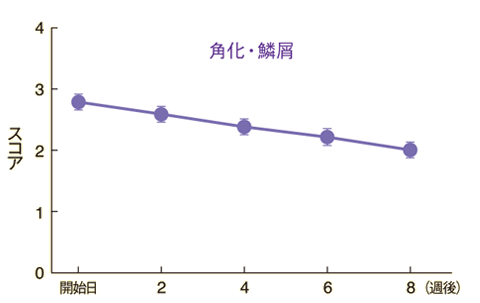
n=90~94 Mean±S.E.
評価基準:紅斑、膿疱・小水疱、角化・鱗屑の各皮膚所見についてそれぞれ「0:なし」「1:軽微」「2:軽度」「3:中等度」「4:高度」の5段階のスコアで評価
皮膚所見の改善度(最終時)
「中等度改善」以上の改善率は77.6%であった。
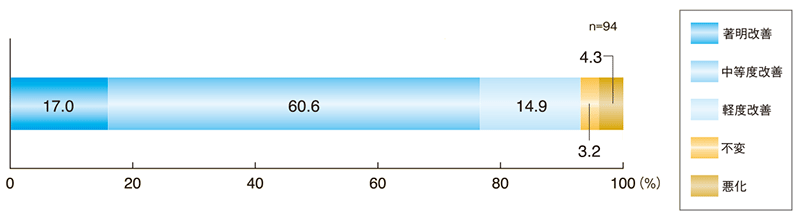
評価基準:下記の皮膚所見合計スコア変化量(開始日と最終時の変化量)に基づいて、最終時(8週後又は中止日)に「著明改善」「中等度改善」「軽度改善」「不変」「悪化」の5段階で評価
| 改善度 | 著明改善 | 中等度改善 | 軽度改善 | 不変 | 悪化 |
|---|---|---|---|---|---|
| 合計スコア変化量 | ‐6以下 | ‐5~‐3 | ‐2~‐1 | 0 | +1以上 |
副作用
副作用は95例中11例13件に認められ、主な副作用は刺激感、尿糖陽性各2件等であった。そのうち、投与中止に至った副作用は適用部位腫脹、適用部位刺激感各1件であった。本試験では死亡例を含む重篤な副作用は認められなかった。
- 7.2
- 本剤は、通常、使用後6週目までに効果が認められているので、治療にあたっては経過を十分に観察し、症状の改善がみられない場合には、漫然と使用を継続しないこと。
- 8.1
- 本剤は活性型ビタミンD3誘導体製剤であり、血中カルシウム値が上昇する可能性がある。また、高カルシウム血症に伴い、急性腎障害の報告があるため、本剤の使用に際しては、血中カルシウム値及び腎機能(血中クレアチニン、BUN等)の検査を定期的(開始2~4週後に1回、その後は適宜)に行うこと。なお、正常域を超えた場合には減量又は使用を中止すること。
- 8.2
- 皮疹が広範囲にある場合や、皮疹重症度が高く、皮膚のバリア機能が低下して本剤の経皮吸収が増加する可能性のある患者では、高カルシウム血症が発現しやすく、急性腎障害に至る可能性もあるため、本剤を少量から使用開始し、観察を十分に行い、血中カルシウム値及び腎機能の検査を定期的に行うこと。
承認時評価資料 : 社内資料 : 掌蹠膿疱症患者を対象とした第Ⅲ相臨床試験



