ヘマンジオルの国内第Ⅲ相臨床試験
試験概要
目的
日本人の乳児血管腫患者を対象として、プロプラノロール経口液剤の有効性と安全性を検討する。
試験デザイン
非対照、非盲検、用量漸増、多施設共同試験
対象
乳児血管腫患者
【選択基準】
- 長径が1.5cm以上の増殖期の乳児血管腫を有する患者
- 登録時に生後35~150日の患者
【主な除外基準】
- 先天性血管腫
- 生命に影響を及ぼす乳児血管腫
- Kasabach-Merritt症候群
- 気管支喘息、気管支痙攣
- 低血糖(血糖値40mg/dL未満又はそのおそれのある患者)
- 低血圧(収縮期50mmHg未満、拡張期30mmHg未満)
- 徐脈(80回/分未満)
- コントロール不良の心不全
方法
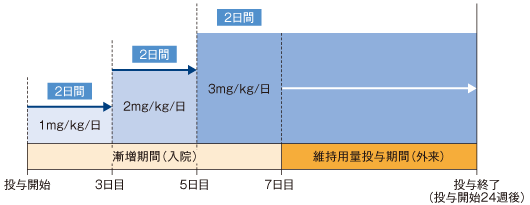
プロプラノロール経口液剤(プロプラノロール0.375%含有)を1日2回(朝・夜)、24週間投与した。投与期間中に、6日間の漸増期間(投与開始日~投与6日目)と維持用量投与期間(投与7日目~24週後まで)を設けた。漸増期間ではプロプラノロール換算で1mg/kg/日の用量で投与を開始し、3mg/kg/日まで原則2日間ごとに1mg/kg/日ずつ漸増し、維持用量を3mg/kg/日とした。

評価項目
【主要評価項目】
24週後における乳児血管腫に対する有効率(血管腫が「治癒又はほぼ治癒」した割合)
【副次評価項目】
- 12週後における乳児血管腫に対する有効率
- 前回来院時からの乳児血管腫の改善率
- 乳児血管腫が改善するまでの期間
- 12週後、24週後における乳児血管腫の面積、長径、色の変化量
【安全性】
有害事象、臨床検査値、バイタルサイン、血糖値(pin-prick)、心電図、身体測定(身長・体重・頭囲)
解析方法
【有効率】
12週後、24週後における乳児血管腫に対する評価の「有効(治癒又はほぼ治癒)」「無効」別の例数、割合及び有効率の95%信頼区間を算出した。海外第Ⅱ/Ⅲ相臨床試験におけるプラセボ群の有効率3.6%(2/55例)の95%信頼区間の0.44%~12.53%から、12%をプラセボ群の推定値とし、24週後における有効率の95%信頼区間の下限値が12%を上回る場合、プロプラノロール経口液剤の有効性が認められると判断することとした。
判定基準
各来院ごとに標準的な手順に従って正面及び側面から撮影された各1枚のデジタル写真を用いて事前にトレーニングを受けた効果判定委員が、患者内比較により下記の定性的な中央判定を行った。
- 乳児血管腫に対する有効判定:12週後、24週後及び中止(来院)日
治療開始日の写真と比較し、乳児血管腫の状態を「有効(治癒又はほぼ治癒)」「無効」の2段階で評価した。
「ほぼ治癒」の定義は「毛細血管拡張、紅斑、皮膚肥厚、軟組織の腫脹、解剖学的な境界の歪みのすべて又はいずれかが最小限になっていること」とした。 - 乳児血管腫の改善判定:5、8、12、16、20、24週後及び中止(来院)日
前回来院時の写真と比較し、毛細血管の拡張、紅斑、皮膚肥厚、軟組織の腫脹、解剖学的な境界の歪みから、乳児血管腫の状態を「改善」「不変」「悪化」の3段階で評価した。 - 乳児血管腫の面積、長径、色の算出:12週後、24週後、中止(来院)日
外部機関が乳児血管腫の面積、長径、色を算出した。
有効性
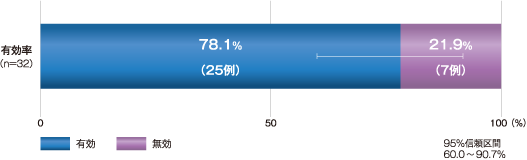
24週後における乳児血管腫に対する有効率(血管腫が「治癒又はほぼ治癒」した割合)(主要評価項目)
24週後の有効率
24週後の乳児血管腫に対する有効率は78.1%(95%信頼区間 60.0~90.7%)で、95%信頼区間の下限値はあらかじめ設定された有効性の判定基準である12%を上回った。
<効能・効果に関連する使用上の注意>
- 本剤についての十分な知識と乳児血管腫の治療経験を持つ医師が、本剤の有益性が危険性を上回ると判断した場合にのみ投与すること。
- 原則として、全身治療が必要な増殖期の乳児血管腫に使用すること。
本剤の承認された【用法・用量】
通常、プロプラノロールとして1日1mg/kg~3mg/kgを2回に分け、空腹時を避けて経口投与する。投与は1日1mg/kgから開始し、2日以上の間隔をあけて1mg/kgずつ増量し、1日3mg/kgで維持するが、患者の状態に応じて適宜減量する。
重要な基本的注意(抜粋)
- 初回投与時及び増量時は、小児科医との連携のもと、心拍数、血圧、呼吸状態、血糖値等を少なくとも投与2時間後まで1時間毎に確認すること。
安全性
本試験における有害事象
有害事象は96.9%(31/32例)に発現し、重症度はいずれも中等度又は軽度であった。本剤との因果関係が否定できない有害事象は、31.3%(10/32例)に発現した。
主な有害事象(発現率5%以上)としては、鼻咽頭炎(10例、31.3%)、下痢(9例、28.1%)、乳児湿疹(8例、25.0%)、発熱(6例、18.8%)、上気道の炎症(6例、18.8%)、湿疹(4例、12.5%)、鼻漏(3例、9.4%)、皮膚乾燥(3例、9.4%)、紅斑(3例、9.4%)、結膜炎(3例、9.4%)、擦過傷(3例、9.4%)、蕁麻疹(2例、6.3%)、便秘(2例、6.3%)、ALT増加(2例、6.3%)、AST増加(2例、6.3%)、拡張期血圧低下(2例、6.3%)、収縮期血圧低下(2例、6.3%)であった。
死亡及びその他の重篤な有害事象は認められなかった。
重要な有害事象〔低血圧、徐脈、うっ血性心不全、房室ブロック等、感染症を除く喘息、気管支痙攣等、低血糖及び治験薬の投与中止(休薬を含む)に至った有害事象〕は5例発現した。内訳は、低血圧3例(拡張期血圧低下及び収縮期血圧低下2例、血圧低下1例)、気管支炎1例、上気道の炎症及び喘鳴1例であった。低血圧の3例はいずれも因果関係が否定できないと判断されたが、いずれも軽度で、無治療で回復した。気管支炎の1例は因果関係が否定されたが、中等度で、治療により回復した。上気道の炎症及び喘鳴の1例は、上気道の炎症については因果関係が否定されたが、喘鳴については因果関係が否定できないと判断され、治療により回復した。
[乳児血管腫患者を対象とした第Ⅲ相臨床試験(承認時評価資料)]
- ※
- 詳細については、製品情報一覧ページ<添付文書><インタビューフォーム>及び総合製品情報概要をご覧ください。
- ※
- 総合製品情報概要をご所望の方は、弊社MR及び製品情報センター(0120-122834)にお問い合わせください。



