ファムシクロビルの単純疱疹に対する追加第Ⅲ相二重盲検比較試験<非劣性試験>
試験概要
対象
16歳以上80歳未満、皮疹出現後48時間以内の中等症以上の単純疱疹患者
-
口唇・顔面ヘルペス:丘疹又は水疱・膿疱が10個以上
-
性器ヘルペス(初発型・再発型):丘疹又は水疱・膿疱が5個以上
-
カポジ水痘様発疹症
ファムビル群:281例、バラシクロビル塩酸塩群:281例
解析は、以下の症例数で実施した。
有効性:ファムビル群279例、バラシクロビル塩酸塩群276例
安全性:ファムビル群281例、バラシクロビル塩酸塩群280例
方法
バラシクロビル塩酸塩を対照としたダブルダミー法による多施設共同二重盲検並行群間比較試験
ファムビル群:ファムビル1回250mgを1日3回、5日間経口投与
バラシクロビル塩酸塩群:バラシクロビル塩酸塩1回500mgを1日2回、5日間経口投与
併用薬・併用療法
治験薬以外の抗ヘルペスウイルス薬、インターフェロン、γ-グロブリン製剤、ステロイド薬*、免疫抑制薬*、プロベネシド**、シメチジン**、テオフィリン**、ミコフェノール酸モフェチル製剤を併用禁止とした。ただし、初発型性器ヘルペスに対しては、治験薬投与終了後に治験責任医師により経口抗ヘルペスウイルス薬の追加投与が必要と判断された場合に限り、追加投与を可とした。また、単純疱疹の病変部位に対するすべての併用療法を禁止とした。
- *:
- 単純疱疹の病変部位以外の外用は可
- **:
- 治験薬投与期間中のみ併用禁止
評価項目
- 主要評価項目
- すべての単純疱疹の病変部位が治癒するまでの日数(検証的解析項目)
- 副次評価項目
- 単純疱疹の病変部位のウイルスが消失するまでの日数
すべての単純疱疹の病変部位が完全痂皮化するまでの日数
単純疱疹の新たな皮疹の形成が停止するまでの日数 - サブグループ解析
- 病型別:すべての単純疱疹の病変部位が治癒するまでの日数
解析計画
主要評価項目である「すべての単純疱疹の病変部位が治癒するまでの日数」に関しては、Kaplan-Meier推定法によりデータを要約するとともに、Cox比例ハザード回帰分析#によりハザード比及びその両側95%信頼区間を算出し、非劣性限界値を0.76とした非劣性検証を行った(ハザード比の信頼下限が0.76を上回ったとき、非劣性が示されたと判定する)。
- #:
- ハザードとは、イベントの発生速度(単位時間あたりのイベント発生頻度)のことであり、ハザード比とは、治験薬のハザード/対照薬のハザードである。比例ハザードモデルとは、どの観察時点においてもハザード比が一定であることを仮定することである。このモデルを利用した回帰分析がCox比例ハザード回帰分析である。
主要評価項目
すべての単純疱疹の病変部位が治癒するまでの日数(検証的解析結果)
治癒までの日数を比較検討したところ、Cox比例ハザード回帰分析により算出したファムビル群のバラシクロビル塩酸塩群に対するハザード比の95%信頼区間の下限が、非劣性限界である0.76を上回ったことから、ファムビル群のバラシクロビル塩酸塩群に対する非劣性が検証された。ファムビル群のすべての単純疱疹の病変部位が治癒するまでの日数の50%点は6日であった。
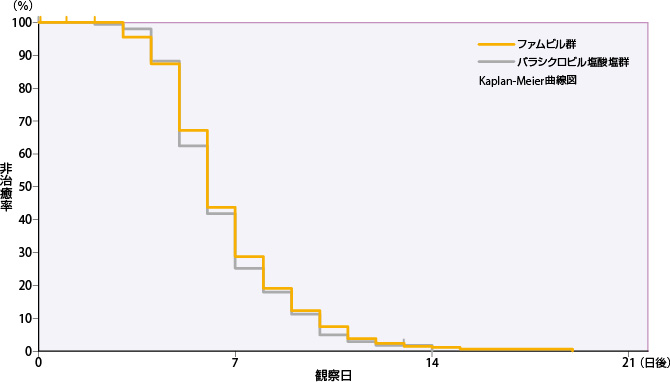
| 投与群 | 評価例数 | 打ち切り 例数 |
すべての単純疱疹の病変部位が 治癒するまでの日数(日) |
ハザード比* | ||||
|---|---|---|---|---|---|---|---|---|
| 点推定値 | 95%信頼区間 | |||||||
| 25%点 | 50%点 | 75%点 | 下限 | 上限 | ||||
| ファムビル群 | 279 | 10 | 5 | 6 | 8 | 0.918 | 0.774 | 1.088 |
| バラシクロビル塩酸塩群 | 276 | 6 | 5 | 6 | 8 | ― | ― | ― |
- *:
- 14日後までに治癒していない場合は、当該症例を打ち切りとし、打ち切り日を14日後とした。
副次評価項目
単純疱疹の病変部位のウイルスが消失するまでの日数
ファムビル群の単純疱疹の病変部位のウイルスが消失するまでの日数の50%点は3日であった。
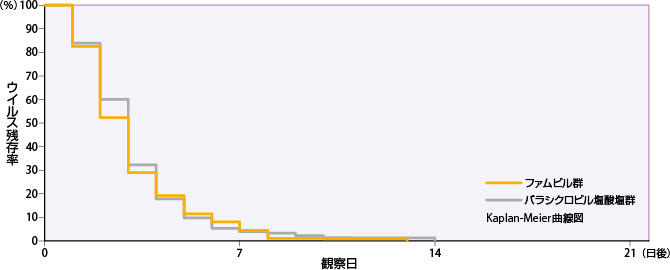
| 投与群 | 評価例数 | 打ち切り 例数 |
単純疱疹の病変部位のウイルスが 消失するまでの日数(日) |
||
|---|---|---|---|---|---|
| 25%点 | 50%点 | 75%点 | |||
| ファムビル群 | 232 | 12 | 2 | 3 | 4 |
| バラシクロビル塩酸塩群 | 226 | 10 | 2 | 3 | 4 |
すべての単純疱疹の病変部位が完全痂皮化するまでの日数
ファムビル群のすべての単純疱疹の病変部位が完全痂皮化するまでの日数の50%点は4日であった。
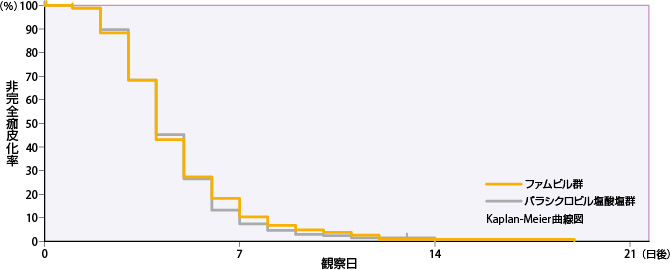
| 投与群 | 評価例数 | 打ち切り 例数 |
すべての単純疱疹の病変部位が 完全痂皮化するまでの日数(日) |
||
|---|---|---|---|---|---|
| 25%点 | 50%点 | 75%点 | |||
| ファムビル群 | 279 | 6 | 3 | 4 | 6 |
| バラシクロビル塩酸塩群 | 276 | 5 | 3 | 4 | 6 |
サブグループ解析
病型別:すべての単純疱疹の病変部位が治癒するまでの日数
①口唇・顔面ヘルペス
ファムビル群のすべての単純疱疹の病変部位が治癒するまでの日数の50%点は6日であった。
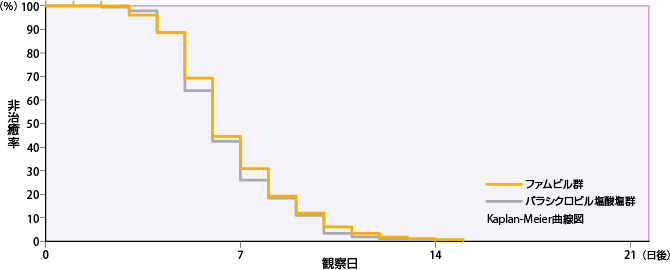
| 投与群 | 評価例数 | 打ち切り 例数 |
すべての単純疱疹の病変部位が 治癒するまでの日数(日) |
||
|---|---|---|---|---|---|
| 25%点 | 50%点 | 75%点 | |||
| ファムビル群 | 199 | 6 | 5 | 6 | 8 |
| バラシクロビル塩酸塩群 | 197 | 2 | 5 | 6 | 8 |
②カポジ水痘様発疹症
ファムビル群のすべての単純疱疹の病変部位が治癒するまでの日数の50%点は6日であった。
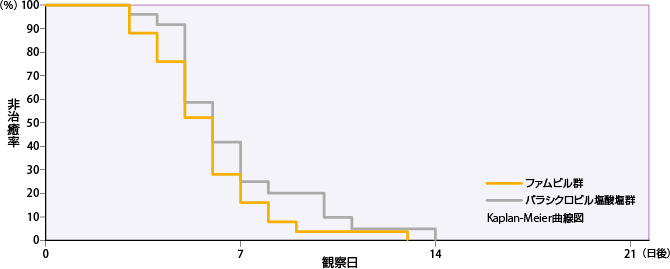
| 投与群 | 評価例数 | 打ち切り 例数 |
すべての単純疱疹の病変部位が 治癒するまでの日数(日) |
||
|---|---|---|---|---|---|
| 25%点 | 50%点 | 75%点 | |||
| ファムビル群 | 25 | 0 | 5 | 6 | 7 |
| バラシクロビル塩酸塩群 | 25 | 2 | 5 | 6 | 8 |
③初発型性器ヘルペス
ファムビル群のすべての単純疱疹の病変部位が治癒するまでの日数の50%点は7日であった。
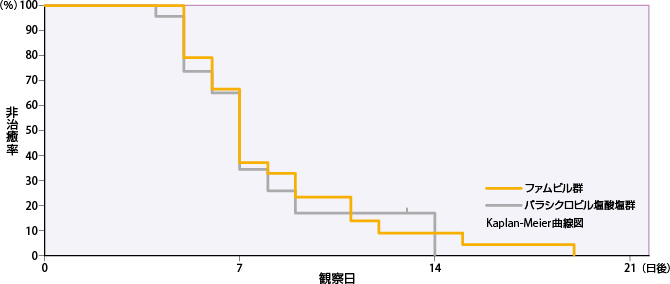
| 投与群 | 評価例数 | 打ち切り 例数 |
すべての単純疱疹の病変部位が 治癒するまでの日数(日) |
||
|---|---|---|---|---|---|
| 25%点 | 50%点 | 75%点 | |||
| ファムビル群 | 24 | 3 | 6 | 7 | 9 |
| バラシクロビル塩酸塩群 | 23 | 1 | 5 | 7 | 9 |
④再発型性器ヘルペス
ファムビル群のすべての単純疱疹の病変部位が治癒するまでの日数の50%点は6日であった。
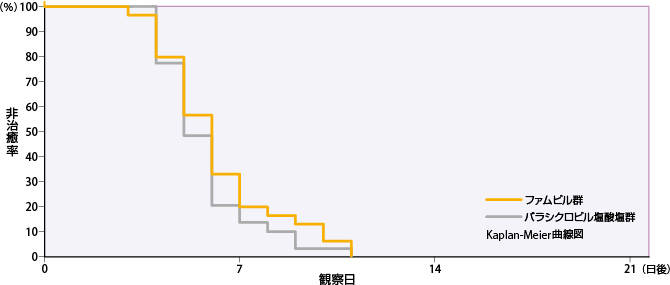
| 投与群 | 評価例数 | 打ち切り 例数 |
すべての単純疱疹の病変部位が 治癒するまでの日数(日) |
||
|---|---|---|---|---|---|
| 25%点 | 50%点 | 75%点 | |||
| ファムビル群 | 31 | 1 | 5 | 6 | 7 |
| バラシクロビル塩酸塩群 | 31 | 1 | 5 | 5 | 6 |
副作用
臨床検査値異常を含む副作用(投与開始日~21日後)は、ファムビル群で281例中25例(8.9%)、バラシクロビル塩酸塩群で280例中21例(7.5%)に認められた。ファムビル群の主な副作用は、傾眠6例(2.1%)、口渇3例(1.1%)、頭痛2例(0.7%)、ALT(GPT)増加2例(0.7%)、CK(CPK)増加2例(0.7%)、γ-GTP 増加2例(0.7%)等であった。バラシクロビル塩酸塩群の主な副作用は、腹部不快感2例(0.7%)、ALT(GPT)増加2例(0.7%)、AST(GOT)増加2例(0.7%)、CK(CPK)増加2例(0.7%)、血中尿素増加2例(0.7%)、尿中血陽性2例(0.7%)等であった。死亡を含む重篤な副作用は両群ともに認められなかった。投与中止に至った副作用として、ファムビル群で悪心及び嘔吐が1例認められ、投与中止後回復した。
- 6. 用法・用量(一部抜粋)
〈単純疱疹〉 - 通常、成人にはファムシクロビルとして1回250mgを1日3回経口投与する。また、再発性の単純疱疹の場合は、通常、成人にはファムシクロビルとして1回1000mgを2回経口投与することもできる。
- 7. 用法・用量に関連する注意(一部抜粋)
〈効能共通〉 -
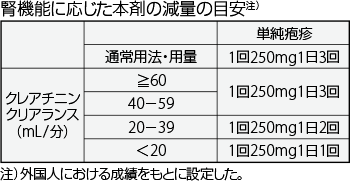
- 7.1
- 腎機能障害患者では投与間隔をあけて減量することが望ましい。腎機能に応じた本剤の投与量及び投与間隔の目安は下表のとおりである。
記事/インライン画像
- 7.2
- 血液透析患者には本剤250mgを透析直後に投与する。なお、次回透析前に追加投与は行わない。
- 〈単純疱疹に対して1回250mgを1日3回投与する場合〉
-
- 7.3
- 本剤の投与は、発病初期に近いほど効果が期待できるので、早期に投与を開始すること。
- 7.4
- 本剤は、原則として、5日間使用すること。改善の兆しが見られないか、あるいは悪化する場合には、速やかに他の治療に切り替えること。
- 8. 重要な基本的注意(一部抜粋)
〈効能共通〉 -
- 8.1
- 意識障害等があらわれることがあるので、自動車の運転等、危険を伴う機械の操作に従事する際には注意するよう患者に十分に説明すること。
- 8.2
- 急性腎障害があらわれることがあるので、腎機能検査を行うなど観察を十分に行うこと。
川島眞ら: 臨床医薬, 29(3), 285(2013)(承認時評価資料)
本試験はマルホ株式会社の資金により行われた。



