コムクロシャンプーの臨床試験(頭部の湿疹・皮膚炎)
頭部の湿疹・皮膚炎*患者を対象とした第Ⅲ相臨床試験1,2)
*:脂漏性皮膚炎を除く
試験概要
- 目的
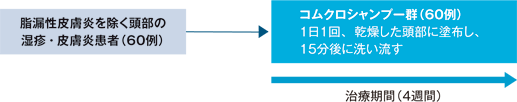
- 脂漏性皮膚炎を除く頭部に湿疹・皮膚炎の症状を有する患者を対象に、コムクロシャンプーの有効性及び安全性を、非盲検、非対照試験により検討する。
- 対象
- 脂漏性皮膚炎を除く頭部の湿疹・皮膚炎患者
- 選択基準
- 治療開始日に以下の条件を満たす患者
- 1)
- IGAが3以上(中等度以上)
- 2)
- 年齢が12歳以上(同意取得日に満たす必要あり)
- 症例数
- 有効性解析集団FAS
60例(アトピー性皮膚炎34例、慢性湿疹11例、接触皮膚炎6例、急性湿疹4例、その他5例)
- 投与方法
- コムクロシャンプーを乾燥した頭部に患部を中心に適量を1日1回(4週間)塗布し、15分後に水又は湯で泡立てて洗い流した。
- 評価項目
- 有効性
主要評価項目:
4週後のIGAが2段階以上改善かつ0又は1になった患者の割合
副次評価項目:
- 1)
- 1週後、2週後のIGAが2段階以上改善かつ0又は1になった患者の割合
- 2)
- 皮膚所見スコア、そう痒スコアの合計スコアの治療開始日からの変化量
- 3)
- 各皮膚所見スコア、そう痒スコアの治療開始日からの変化量
- 4)
- DLQIスコア又はCDLQI(Children's DLQI)スコアの変化量
- 5)
- 病変範囲スコアの治療開始日からの変化量(有効性評価対象疾患がアトピー性皮膚炎患者のみ)
- 6)
- mEASI(modified Eczema Area and Severity Index)の治療開始日からの変化量及び変化率(有効性評価対象疾患がアトピー性皮膚炎患者のみ)
安全性
有害事象(自覚症状及び他覚所見、臨床検査値異常変動)及び臨床検査値
- 解析計画
-
主要評価項目
FASを対象に、各評価日のIGA各カテゴリの例数を集計し、治療開始日と比較しIGAが2段階以上改善かつ0又は1になった患者の例数及び割合を算出した。
副次評価項目
- 1)
- 1週後、2週後のIGAが2段階以上改善かつ0又は1になった患者の割合:主要評価項目と同様。
- 2)~6):
- 各評価日の要約統計量を算出した。
- 5)
- 病変範囲スコアの治療開始日からの変化量及び6)mEASIの治療開始日からの変化量及び変化率は、事前に規定されたサブグループ解析として、アトピー性皮膚炎患者を有効性評価対象疾患として解析した。
試験デザイン
有効性
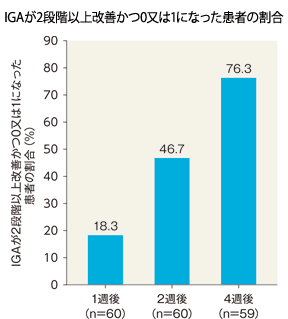
4週後のIGAが2段階以上改善かつ0又は1になった患者の割合(FAS)[主要評価項目]
1週後、2週後のIGAが2段階以上改善かつ0又は1になった患者の割合(FAS)[副次評価項目]
治療開始日と比較し、IGAが2段階以上改善かつ0又は1になった患者の割合は、1週後は18.3%(11/60例)、2週後は46.7%(28/60例)、4週後は76.3%(45/59例)であった。
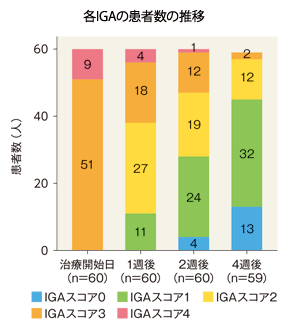
| IGAスコア | 治療開始日(n=60) | 1週後(n=60) | 2週後(n=60) | 4週後(n=59) |
|---|---|---|---|---|
| 0 | 0 | 0 | 4(6.7) | 13(22.0) |
| 1 | 0 | 11(18.3) | 24(40.0) | 32(54.2) |
| 2 | 0 | 27(45.0) | 19(31.7) | 12(20.3) |
| 3 | 51(85.0) | 18(30.0) | 12(20.0) | 2(3.4) |
| 4 | 9(15.0) | 4(6.7) | 1(1.7) | 0 |
| IGAが2段階以上改善かつ 0又は1になった患者 |
― | 11(18.3) | 28(46.7) | 45(76.3) |
例数(%)
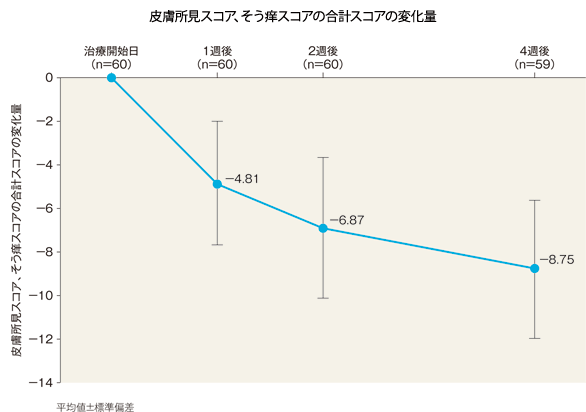
皮膚所見スコア、そう痒スコアの合計スコアの治療開始日からの変化量(FAS)[副次評価項目]
皮膚所見スコア、そう痒スコアの合計スコアの変化量(平均値)は、1週後は−4.81、2週後は−6.87、4週後は−8.75であった。
| 皮膚所見スコア、そう痒スコアの合計スコア | |
|---|---|
| 治療開始日(n=60) | 11.40±2.78 |
| 1週後(n=60) | 6.59±3.35 |
| 2週後(n=60) | 4.53±3.06 |
| 4週後(n=59) | 2.63±2.64 |
平均値±標準偏差
各皮膚所見スコア、そう痒スコアの治療開始日からの変化量(FAS)[副次評価項目]
4週後の紅斑、浸潤/丘疹、掻破痕、苔癬化、鱗屑の各皮膚所見スコア及びそう痒スコアの変化量(平均値)は、−1.55、−1.45、−1.43、−1.23、−1.62及び−1.47であった。
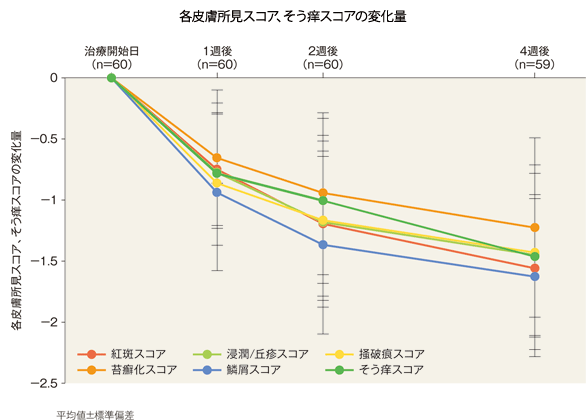
各皮膚所見スコア、そう痒スコア
| 紅斑スコア | 浸潤/丘疹スコア | 掻破痕スコア | 苔癬化スコア | 鱗屑スコア | そう痒スコア | |
|---|---|---|---|---|---|---|
| 治療開始日 (n=60) |
2.19±0.37 | 1.83±0.63 | 1.75±0.73 | 1.52±0.82 | 2.03±0.61 | 2.08±0.49 |
| 1週後(n=60) | 1.43±0.59 | 1.04±0.70 | 0.88±0.67 | 0.86±0.74 | 1.08±0.65 | 1.29±0.58 |
| 2週後(n=60) | 1.00±0.62 | 0.65±0.65 | 0.58±0.51 | 0.57±0.65 | 0.66±0.55 | 1.08±0.64 |
| 4週後(n=59) | 0.64±0.57 | 0.38±0.54 | 0.31±0.46 | 0.28±0.55 | 0.41±0.45 | 0.60±0.64 |
平均値±標準偏差
判定基準:各皮膚所見スコア、そう痒スコア
| 重症度スコア | 重症度 | そう痒 |
|---|---|---|
| 0 | なし | なし |
| 0.5 | ┇ | ┇ |
| 1 | 軽症 | あまり気にならない程度のわずかなかゆみがある |
| 1.5 | ┇ | ┇ |
| 2 | 中等症 | 眠れないほどではないが、明らかなかゆみがある |
| 2.5 | ┇ | ┇ |
| 3 | 重症 | 夜間眠れないほどの激しいかゆみ |
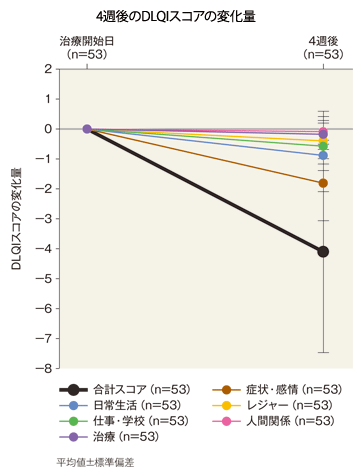
DLQIスコア又はCDLQIスコアの変化量(FAS)[副次評価項目]
4週後のDLQI合計スコア、症状・感情、日常生活、レジャー、仕事・学校、人間関係及び治療の変化量(平均値)は、−4.1、−1.8、−0.9、−0.4、−0.6、−0.1及び−0.2であった。また、4週後のCDLQI合計スコア、症状・感情、レジャー、学校・休日、人間関係、睡眠及び治療の変化量(平均値)は、−3.6、−2.6、−0.1、−0.3、0.0、−1.0及び0.4であった。
| CDLQIスコア 評価患者 (n=7) |
|
|---|---|
| 合計スコア | −3.6±3.2 |
| 症状・感情 | −2.6±2.1 |
| レジャー | −0.1±0.4 |
| 学校・休日 | −0.3±0.5 |
| 人間関係 | 0.0±0.0 |
| 睡眠 | −1.0±1.2 |
| 治療 | 0.4±0.8 |
平均値±標準偏差
4週後のDLQIスコア
| 合計スコア | 症状・感情 | 日常生活 | レジャー | 仕事・学校 | 人間関係 | 治療 | |
|---|---|---|---|---|---|---|---|
| 治療開始日 | 5.9±3.8 | 2.8±1.4 | 1.1±1.2 | 0.6±0.8 | 0.8±0.8 | 0.2±0.4 | 0.5±0.8 |
| 4週後 | 1.8±1.7 | 1.0±0.9 | 0.2±0.4 | 0.2±0.5 | 0.2±0.4 | 0.0±0.1 | 0.2±0.5 |
平均値±標準偏差、n=53
病変範囲スコアの治療開始日からの変化量(有効性評価対象疾患がアトピー性皮膚炎患者のみ)[副次評価項目]:サブグループ解析
病変範囲スコアの変化量(平均値)は、1週後は−0.6、2週後は−1.3、4週後は−2.1であった。
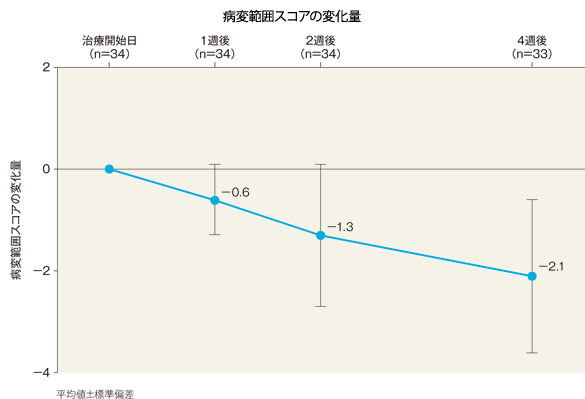
| 病変範囲スコア | |
|---|---|
| 治療開始日(n=34) | 4.2±1.3 |
| 1週後(n=34) | 3.6±1.6 |
| 2週後(n=34) | 2.9±1.6 |
| 4週後(n=33) | 2.0±1.7 |
平均値±標準偏差
判定基準:病変範囲スコア
病変範囲は7段階(0~6)で評価した。
| 範囲(%) | 病変範囲 スコア |
|---|---|
| 0 | 0 |
| 1≦〜<10 | 1 |
| 10≦〜<30 | 2 |
| 30≦〜<50 | 3 |
| 50≦〜<70 | 4 |
| 70≦〜<90 | 5 |
| 90≦〜100 | 6 |
mEASIの治療開始日からの変化量及び変化率(有効性評価対象疾患がアトピー性皮膚炎患者のみ)[副次評価項目]:サブグループ解析
mEASIの変化量(平均値)は、1週後は−12.65、2週後は−19.66、4週後は−24.52であった。また、mEASIの変化率は、1週後は−42.93%、2週後は−61.27%、4週後は−78.85%であった。
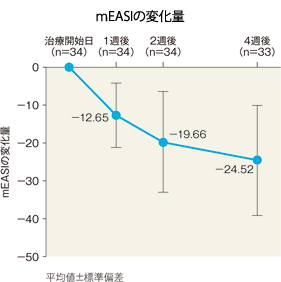
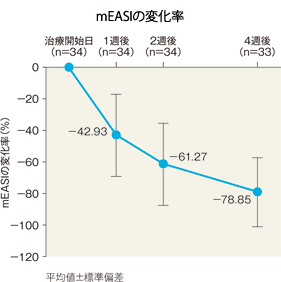
| mEASI | |
|---|---|
| 治療開始日(n=34) | 31.75±15.52 |
| 1週後(n=34) | 19.10±12.91 |
| 2週後(n=34) | 12.09±9.55 |
| 4週後(n=33) | 6.98±7.77 |
平均値±標準偏差
判定基準:mEASI(modified Eczema Area and Severity Index、頭部のみを評価するEASI)
EASIは、アトピー性皮膚炎の皮膚所見の重症度と病変範囲から全身のアトピー性皮膚炎の重症度を数値化した評価法であり、本邦のアトピー性皮膚炎診療ガイドラインにおいても重症度分類として紹介されている指標である。本試験では頭部のアトピー性皮膚炎についてのみ症状を評価するためにmEASIとして判定した。
mEASI=(紅斑スコア+浸潤/丘疹スコア+掻破痕スコア+苔癬化スコア)*×病変範囲スコア
*: 各皮膚所見重症度スコアが0.5の場合は1に換算してmEASIを計算した
安全性
本試験において、副作用は、60例中4例(6.7%)に認められた。
本試験において、死亡例及び重篤な有害事象、投与中止に至った有害事象は認められなかった。
| 安全性解析対象例数 | 60 |
|---|---|
| 副作用発現例数(%) | 4(6.7) |
| 副作用の種類 | 副作用発現例数(%) |
|---|---|
| 感染症および 寄生虫症 |
3(5.0) |
|
適用部位毛包炎 |
3(5.0) |
| 一般・全身障害および投与部位の状態 | 1(1.7) |
|
適用部位刺激感 |
1(1.7) |
MedDRA/J Ver.21.1
- 7. 用法・用量に関連する注意
- 本剤使用中には患者の病態を十分観察し、使用4週間を目安に本剤の必要性を検討し、漫然と使用を継続しないこと。
[17.1.1-17.1.3参照]
- 8.1
- 本剤の使用により症状の改善がみられない場合又は症状の悪化をみる場合は使用を中止すること。
- 8.2
- 眼及び眼瞼皮膚へ付着した場合、白内障、緑内障を含む眼障害が発現する可能性がある。眼及び眼瞼皮膚へ付着しないよう注意し、付着した場合は直ちに水で洗い流すこと。
- 社内資料: 脂漏性皮膚炎を除く頭皮の湿疹・皮膚炎患者を対象とした第Ⅲ相臨床試験(一般臨床試験)(承認時評価資料)
- 五十嵐敦之ら: 新薬と臨牀, 69(9), 1066(2020)[利益相反]本試験に関する費用はマルホ株式会社が負担した。



