コムクロシャンプーの臨床試験(頭部の脂漏性皮膚炎)
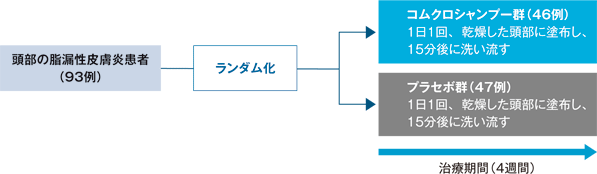
頭部の脂漏性皮膚炎患者を対象とした第Ⅲ相臨床試験1,2)
試験概要
- 目的
- 頭部に脂漏性皮膚炎の皮疹を有する患者を対象に、コムクロシャンプーの有効性及び安全性を、コムクロシャンプープラセボ(以下、プラセボ)を対照とした二重盲検並行群間比較試験により検討する。
- 対象
- 頭部の脂漏性皮膚炎患者
- 選択基準
- 治療開始日に以下の条件を満たす患者
- 1)
- 頭部の脂漏性皮膚炎の各皮膚所見スコア(紅斑、鱗屑)、そう痒スコアがすべて2以上(いずれも中等症以上の症状)
- 2)
- 頭部の病変範囲スコアが2以上(頭部の病変範囲が30%以上)
- 3)
- IGA(Investigator's Global Assessment)が3以上(中等度以上)
- 4)
- 年齢が12歳以上(同意取得日に満たす必要あり)
- 症例数
- 有効性解析集団FAS
93例(コムクロシャンプー群46例、プラセボ群47例)
- 投与方法
- コムクロシャンプー又はプラセボを、乾燥した頭部に患部を中心に適量を1日1回(4週間)塗布し、15分後に水又は湯で泡立てて洗い流した。
- 評価項目
-
有効性
主要評価項目:4週後のTSS(Total Severity Score)の治療開始日からの変化量
副次評価項目:
- 1)
- 治療開始日と比較し、IGAが2段階以上改善かつ0又は1になった患者の割合
- 2)
- 紅斑スコア、鱗屑スコア、そう痒スコアの治療開始日からの変化量
- 3)
- SDASI(Seborrheic Dermatitis Area and Severity Index)の治療開始日からの変化量
- 4)
- 病変範囲スコアの治療開始日からの変化量
- 5)
- DLQIスコアの治療開始日からの変化量
安全性
有害事象(自覚症状及び他覚所見、臨床検査値異常変動)及び臨床検査値
- 解析計画
-
主要評価項目
FASを対象に、各評価日のTSS変化量を応答変数とし、評価日、投与群及び評価日×投与群の交互作用を固定効果、評価日間の相関構造にUnstructured(無相関)を仮定した混合効果モデルを用いた解析を行った。投与群ごとの最小二乗平均、群間差の最小二乗平均、標準誤差、最小二乗平均の両側95%信頼区間を算出した。また、混合効果モデルから得られた最小二乗平均を用い、評価日ごとに各群推定値の経時推移図を作成した。群間比較の際、両側有意水準5%とした。補足的解析として治験実施計画書に適合した対象集団(PPS)を対象とした解析を行った。
副次評価項目
FASを対象に解析を行い、検定の際は評価項目及び時点間の多重性の調整は行わず、一律に有意水準は両側5%とした。
- 1)
- 治療開始日と比較し、IGAが2段階以上改善かつ0又は1になった患者の割合:ピアソンのカイ二乗検定で群間比較を行った。
- 2)
- 紅斑スコア、鱗屑スコア、そう痒スコアの治療開始日からの変化量:主要評価項目に対する主要な解析と同様の解析を行った。
- 3)
- SDASIの治療開始日からの変化量:主要評価項目に対する主要な解析と同様の解析を行った。
- 4)
- 病変範囲スコアの治療開始日からの変化量:主要評価項目に対する主要な解析と同様の解析を行った。
- 5)
- DLQIスコアの治療開始日からの変化量:対応のないStudentのt検定で群間比較を行った。
試験デザイン
有効性
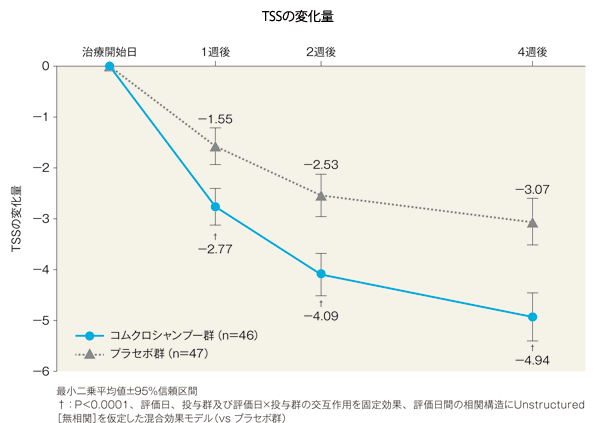
4週後のTSSの治療開始日からの変化量(FAS)[主要評価項目]
4週後のTSSの変化量(最小二乗平均値)は、コムクロシャンプー群では-4.94、プラセボ群では-3.07であった。両群間の差(コムクロシャンプー群-プラセボ群、最小二乗平均値)は-1.87(95%信頼区間:−2.53~−1.21)であり、統計学的に有意な差が認められた(P<0.0001、評価日、投与群及び評価日×投与群の交互作用を固定効果、評価日間の相関構造にUnstructured[無相関]を仮定した混合効果モデル)。
TSS
| コムクロシャンプー群(n=46) | プラセボ群(n=47) | |
|---|---|---|
| 治療開始日 | 6.65±0.82 | 6.78±0.80 |
| 1週後 | 3.88±1.52 | 5.22±1.52 |
| 2週後 | 2.61±1.36 | 4.24±1.92 |
| 4週後 | 1.75±1.38 | 3.70±2.00 |
平均値±標準偏差
判定基準:TSS(Total Severity Score)
TSSとは、脂漏性皮膚炎の主要な症状である各皮膚所見とそう痒の重症度をそれぞれ7段階(0~3、0.5刻み)で評価し、それらのスコアを合計した指標(最大スコア:9)である。| 重症度スコア | 重症度 | 紅斑 | 鱗屑 | そう痒 |
|---|---|---|---|---|
| 0 | なし | なし | なし | なし |
| 0.5 | ┇ | ┇ | ┇ | ┇ |
| 1 | 軽症 | 薄いピンク色 | いくつか肉眼で確認できる鱗屑 | あまり気にならない程度のわずかなかゆみがある |
| 1.5 | ┇ | ┇ | ┇ | ┇ |
| 2 | 中等症 | 赤色の紅斑を容易に確認できる | 多くの鱗屑がある | 眠れないほどではないが、明らかなかゆみがある |
| 2.5 | ┇ | ┇ | ┇ | ┇ |
| 3 | 重症 | 強い赤色 | 非常に多くの、厚みのある黄白色の鱗屑がある | 夜間眠れないほどの激しいかゆみ |
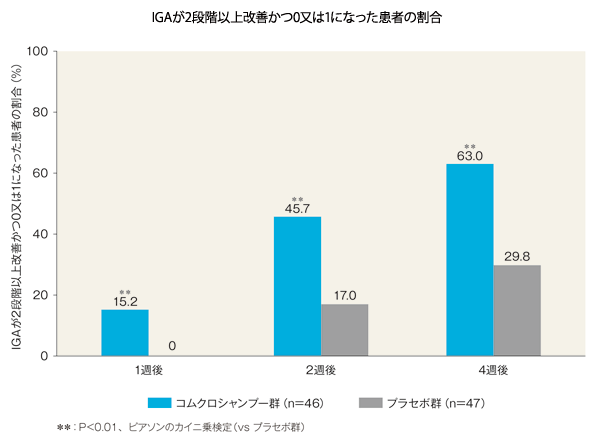
治療開始日と比較し、IGAが2段階以上改善かつ0又は1になった患者の割合(FAS)[副次評価項目]
治療開始日と比較し、4週後にIGAが2段階以上改善かつ0又は1になった患者の割合は、コムクロシャンプー群では63.0%(29/46例)、プラセボ群では29.8%(14/47例)であった。両群間の差(コムクロシャンプー群-プラセボ群)は33.3(95%信頼区間:12.5~51.7)であり、統計学的に有意な差が認められた(P=0.0013、ピアソンのカイ二乗検定)。
IGAが2段階以上改善かつ0又は1になった患者数
| コムクロシャンプー群 (n=46) |
プラセボ群 (n=47) |
P値 (95%信頼区間) |
|
|---|---|---|---|
| 1週後 | 7(15.2) | 0 | 0.0054 (−5.3~34.5) |
| 2週後 | 21(45.7) | 8(17.0) | 0.0029 (7.8~46.4) |
| 4週後 | 29(63.0) | 14(29.8) | 0.0013 (12.5~51.7) |
治療開始日と比較し、IGAが2段階以上改善かつ0又は1になった患者数、例数(%)
ピアソンのカイ二乗検定(vs プラセボ群)
欠測はWorst observation carried forward(以下、WOCF)で補完した。
判定基準:IGA(Investigator's Global Assessment)
IGAスコアとは湿疹・皮膚炎の皮膚所見から、疾患の重症度を5段階(0~4)で評価する指標であり、炎症の程度を総合的に評価できる。
| スコア | 重症度 | 定義 |
|---|---|---|
| 0 | なし | 臨床的な所見、症状はなし。 |
| 1 | 軽微 | 非常にわずかな所見、症状がみられる。 |
| 2 | 軽度 | わずかな所見、症状がみられる。 |
| 3 | 中等度 | 明らかに観察可能な所見、症状がはっきりみられる。 |
| 4 | 重度 | 重度の所見、症状がみられる。 |
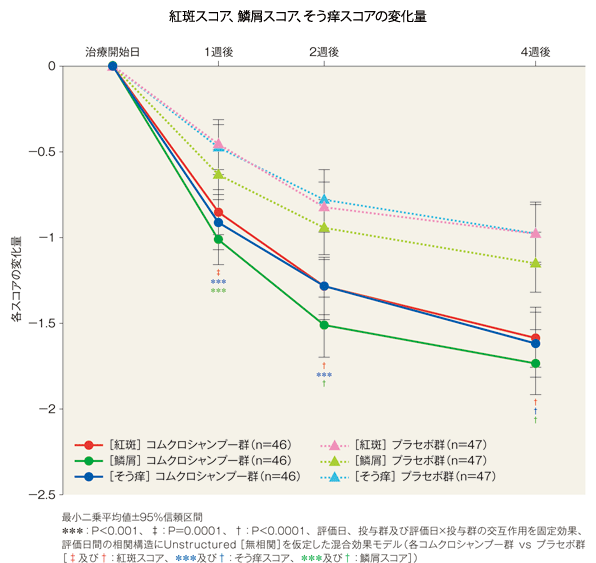
紅斑スコア、鱗屑スコア、そう痒スコアの治療開始日からの変化量(FAS)[副次評価項目]
4週後の紅斑スコア、鱗屑スコア及びそう痒スコアの変化量(最小二乗平均値)は、コムクロシャンプー群では-1.58、-1.73及び-1.62、プラセボ群では-0.97、-1.14及び-0.97であった。両群間の差(コムクロシャンプー群−プラセボ群、最小二乗平均値)はそれぞれ、−0.61、−0.59及び−0.66(95%信頼区間:−0.86~−0.37、−0.85~−0.33及び−0.91~−0.40)であり、統計学的に有意な差が認められた(P<0.0001、投与群及び評価日×投与群の交互作用を固定効果、評価日間の相関構造にUnstructured[無相関]を仮定した混合効果モデル)。
紅斑スコア、鱗屑スコア、そう痒スコア
| コムクロシャンプー群(n=46) | プラセボ群(n=47) | ||
|---|---|---|---|
| 紅斑スコア | 治療開始日 | 2.27±0.38 | 2.30±0.34 |
| 1週後 | 1.42±0.61 | 1.84±0.48 | |
| 2週後 | 1.00±0.51 | 1.48±0.64 | |
| 4週後 | 0.70±0.62 | 1.33±0.65 | |
| 鱗屑スコア | 治療開始日 | 2.23±0.34 | 2.28±0.36 |
| 1週後 | 1.22±0.63 | 1.65±0.64 | |
| 2週後 | 0.72±0.58 | 1.34±0.77 | |
| 4週後 | 0.51±0.54 | 1.14±0.83 | |
| そう痒スコア | 治療開始日 | 2.15±0.28 | 2.20±0.29 |
| 1週後 | 1.24±0.57 | 1.73±0.62 | |
| 2週後 | 0.89±0.58 | 1.43±0.71 | |
| 4週後 | 0.53±0.44 | 1.23±0.72 |
平均値±標準偏差
SDASIの治療開始日からの変化量(FAS)[副次評価項目]
4週後のSDASIの変化量(最小二乗平均値)は、コムクロシャンプー群では-10.03、プラセボ群では-7.15であった。両群間の差(コムクロシャンプー群−プラセボ群、最小二乗平均値)は−2.88(95%信頼区間:−4.55~−1.21)であり、統計学的に有意な差が認められた(P=0.0009、評価日、投与群及び評価日×投与群の交互作用を固定効果、評価日間の相関構造にUnstructured[無相関]を仮定した混合効果モデル)。
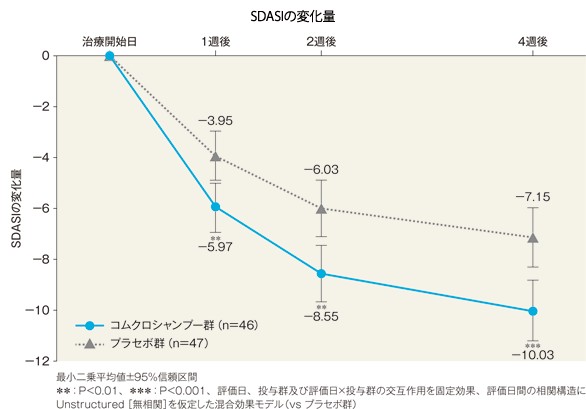
SDASI
| コムクロシャンプー群(n=46) | プラセボ群(n=47) | |
|---|---|---|
| 治療開始日 | 12.29±4.02 | 13.24±4.53 |
| 1週後 | 6.33±4.53 | 9.30±4.98 |
| 2週後 | 3.81±3.57 | 7.21±5.77 |
| 4週後 | 2.40±3.31 | 6.10±5.73 |
平均値±標準偏差
判定基準:SDASI(Seborrheic Dermatitis Area and Severity Index)
SDASI=(紅斑スコア+鱗屑スコア)×病変範囲スコア病変範囲スコアの治療開始日からの変化量(FAS)[副次評価項目]
4週後の病変範囲スコアの変化量(最小二乗平均値)は、コムクロシャンプー群では-1.5、プラセボ群では-0.7であった。両群間の差(コムクロシャンプー群−プラセボ群、最小二乗平均値)は−0.7(95%信頼区間:−1.1~−0.3)であり、統計学的に有意な差が認められた(P=0.0006、評価日、投与群及び評価日×投与群の交互作用を固定効果、評価日間の相関構造にUnstructured[無相関]を仮定した混合効果モデル)。
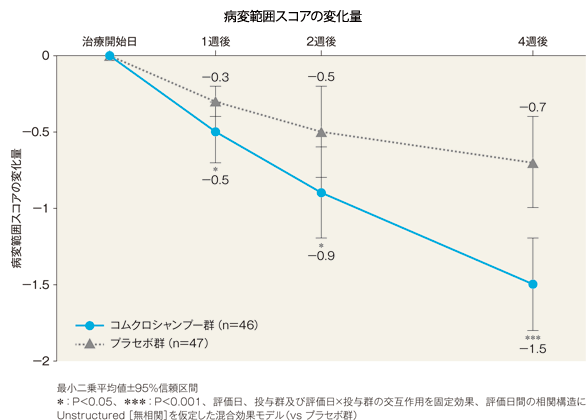
病変範囲スコア
| コムクロシャンプー群(n=46) | プラセボ群(n=47) | |
|---|---|---|
| 治療開始日 | 2.7±0.7 | 2.9±0.8 |
| 1週後 | 2.2±1.0 | 2.6±1.0 |
| 2週後 | 1.8±1.2 | 2.3±1.2 |
| 4週後 | 1.3±1.2 | 2.1±1.2 |
平均値±標準偏差
判定基準:病変範囲スコア
病変範囲は5段階(0~4)で評価した。
| 範囲(%) | 病変範囲スコア |
|---|---|
| 0≦〜<10 | 0 |
| 10≦〜<30 | 1 |
| 30≦〜<50 | 2 |
| 50≦〜<70 | 3 |
| 70≦〜100 | 4 |
DLQIスコアの治療開始日からの変化量(FAS)[副次評価項目]
4週後の症状・感情の両群間の差(コムクロシャンプー群−プラセボ群、平均値)は−0.8(95%信頼区間:−1.3~−0.2)であり、統計学的に有意な差が認められた(P=0.0063、Studentのt検定)。なお、その他の項目及び合計スコアにおいては有意差は認められなかった。
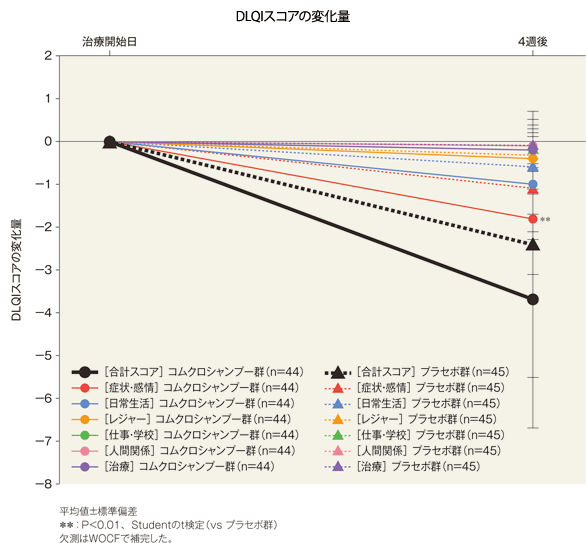
4週後のDLQIスコア
| コムクロシャンプー群(n=44) | プラセボ群(n=45) | |
|---|---|---|
| 合計スコア | 1.1±1.2 | 2.9±3.2 |
| 症状・感情 | 0.8±0.6 | 1.6±1.1 |
| 日常生活 | 0.1±0.5 | 0.6±1.1 |
| レジャー | 0.1±0.3 | 0.2±0.6 |
| 仕事・学校 | 0.0±0.2 | 0.3±0.6 |
| 人間関係 | 0.0±0.0 | 0.1±0.3 |
| 治療 | 0.1±0.3 | 0.2±0.4 |
平均値±標準偏差
欠測はWOCFで補完した。
安全性
本試験において、副作用は、コムクロシャンプー群では46例中2例(4.3%)に認められた。一方、プラセボ群では47例中2例(4.3%)に認められた。
本試験において、死亡例及び重篤な有害事象は認められなかった。投与中止に至った有害事象は、コムクロシャンプー群で1例(接触皮膚炎)が認められた。
| コムクロシャンプー群 | プラセボ群 | |
|---|---|---|
| 安全性解析対象例数 | 46 | 47 |
| 副作用発現例数(%) | 2(4.3) | 2(4.3) |
| 副作用の種類 | 副作用発現例数(%) | |
|---|---|---|
| コムクロシャンプー群 | プラセボ群 | |
| 感染症および寄生虫症 | 1(2.2) | 0 |
|
適用部位毛包炎 |
1(2.2) | 0 |
| 皮膚および皮下組織障害 | 2(4.3) | 0 |
|
ざ瘡 |
1(2.2) | 0 |
|
接触皮膚炎 |
1(2.2) | 0 |
| 一般・全身障害および投与部位の状態 | 0 | 1(2.1) |
|
適用部位刺激感 |
0 | 1(2.1) |
| 臨床検査 | 0 | 1(2.1) |
|
血中ビリルビン増加 |
0 | 1(2.1) |
MedDRA/J Ver.21.1
- 7. 用法・用量に関連する注意
- 本剤使用中には患者の病態を十分観察し、使用4週間を目安に本剤の必要性を検討し、漫然と使用を継続しないこと。
[17.1.1-17.1.3参照] - 8. 重要な基本的注意
-
- 8.1
- 本剤の使用により症状の改善がみられない場合又は症状の悪化をみる場合は使用を中止すること。
- 8.2
- 眼及び眼瞼皮膚へ付着した場合、白内障、緑内障を含む眼障害が発現する可能性がある。眼及び眼瞼皮膚へ付着しないよう注意し、付着した場合は直ちに水で洗い流すこと。
- 社内資料: 頭皮の脂漏性皮膚炎患者を対象とした第Ⅲ相臨床試験(プラセボ対照試験)(承認時評価資料)
- 五十嵐敦之ら: 新薬と臨牀, 69(8), 923(2020) [利益相反]本試験に関する費用はマルホ株式会社が負担した。著者のうち3名はマルホ株式会社の社員である。著者にはマルホ株式会社より講演料、コンサルタント料などを受領しているものが含まれる。



