体幹部に尋常性ざ瘡を有する患者を対象とした 第Ⅲ相非対照試験(M605110-06試験)
本剤の審査報告書では、体幹部に尋常性ざ瘡を有する患者への本剤の使用に関し以下の通りPMDAの見解が示されている。
参考として、本試験結果を示す。
- 【ベピオウォッシュゲルの体幹部の尋常性ざ瘡への使用に関するPMDAの見解】
- 体幹部の尋常性ざ瘡については、適切な対照と比較した本剤の有効性が示されていないこと等から、体幹部に対して本剤の投与を広く推奨することはできない。ただし、尋常性ざ瘡の病態、本薬の作用機序、M605110-06試験※の成績を踏まえると、体幹部に尋常性ざ瘡も有する患者に対する本剤の安全性および有効性に、当該患者に対する本剤の使用を禁止する程の大きな問題があるとまでは言えない。(ベピオウォッシュゲル5%審査報告書より要約)
※:体幹部に尋常性ざ瘡を有する患者を対象とした第Ⅲ相非対照試験
試験概要
社内資料(ベピオウォッシュゲル5% 体幹部に尋常性ざ瘡を有する患者を対象とした第Ⅲ相非対照試験)[承認時評価資料]
- 目的
- 尋常性ざ瘡患者に対する治療として、ベピオウォッシュゲル5%を塗布し、5~10分後に洗い流すショートコンタクトセラピーにより、体幹部に1日1回12週間投与した際の有効性および安全性の確認
- 試験デザイン
- 非対照、多施設共同試験
- 対象
- 胸部※1または背部※2のいずれかから以下の基準を満たす有効性評価対象部位を選定できる9歳以上49歳以下の尋常性ざ瘡患者
- 10個以上40個以下の炎症性皮疹(紅色丘疹と膿疱)を有する
- 10個以上50個以下の非炎症性皮疹(閉鎖面皰と開放面皰)を有する
- 結節または嚢腫が2個以下である
- 試験薬の塗布が可能な部位である
- 方法
- 1日1回、ベピオウォッシュゲル5%を適量塗布し、5〜10分後に洗い流した。投与部位は、尋常性ざ瘡の皮疹のある胸部※1全体または背部※2全体とし、塗布量は手のひら2枚分の面積に対して0.5gを目安とした。
- ベピオウォッシュゲル5%群:ベピオウォッシュゲル5%を塗布
- 解析対象
- 有効性および安全性
ベピオウォッシュゲル5%群:42例 - 評価日
- 登録日※3、2、4、6、8、10、12週後または中止日
- 評価項目
-
- 1)
主要評価項目:12週後の総皮疹数※4の減少率
- 2)
副次評価項目:各評価日の総皮疹数※4、炎症性皮疹数、非炎症性皮疹数の減少率の経時推移、登録日※3と比較し、IGA※5が2段階以上改善かつ0または1になった患者の割合 など
- 3)
その他の有効性評価項目:登録日※3と比較し、各評価日の皮疹数(総皮疹数※4、炎症性皮疹数、非炎症性皮疹数)の減少率が75%以上、90%以上であった患者の割合
- 4)
安全性:有害事象、臨床検査値、皮膚安全性スコア(鱗屑、紅斑)
- 1)
- 解析計画
-
- 1)
有効性
FAS※6を対象に、皮疹数(総皮疹数※4、炎症性皮疹数、非炎症性皮疹数)の減少率の要約統計量、平均値に対する両側95%信頼区間を時点ごとに算出した。
登録日※3と比較し、IGA※5が2段階以上改善かつ0または1になった患者の割合、および各評価日の皮疹数(総皮疹数※4、炎症性皮疹数、非炎症性皮疹数)の減少率が75%以上、90%以上であった患者の割合を算出した。 - 2)
安全性
安全性解析対象集団を対象に、有害事象はMedDRA/J(Ver.25.0)を用いて、器官別大分類(SOC)および基本語(PT)別に集計した。
- 1)
- 頸部下界から心窩部を左右に延長した線までの範囲
- 頸部下界から腰部までの範囲
- 登録日をベースラインとした。
- 炎症性皮疹数と非炎症性皮疹数の合計
- Investigator's Global Assessment:尋常性ざ瘡の重症度を医師が評価する指標の1つで、「0:皮疹なし」、「1:ほぼ皮疹なし」、「2:軽度」、「3:中等度」、「4:重度」の5段階で評価する。
- Full analysis set(最大の解析対象集団):登録後に試験薬を塗布し、有効性評価が行われた患者
患者背景
人口統計学的特性およびその他の基準値の特性(FAS)
| ベピオウォッシュゲル5%群 (n=42) |
||
|---|---|---|
| 性別、例数(%) | 男 | 24(57.1) |
| 女 | 18(42.9) | |
| 年齢、例数(%) | 9~11歳 | 0(0) |
| 12~15歳 | 4(9.5) | |
| 16~20歳 | 11(26.2) | |
| 21~30歳 | 11(26.2) | |
| 31~40歳 | 7(16.7) | |
| 41~49歳 | 9(21.4) | |
| 平均値±標準偏差(歳) | 27.8±10.8 | |
| 治療期間の併用薬剤※、例数(%) | あり | 13(30.2) |
| なし | 30(69.8) | |
| ベースラインの総皮疹数(個) | 平均値±標準偏差 | 49.6±14.7 |
| 中央値(最小値、最大値) | 49.5(21、79) | |
| ベースラインの炎症性皮疹数(個) | 平均値±標準偏差 | 19.4±6.9 |
| 中央値(最小値、最大値) | 16.5(10、35) | |
| ベースラインの非炎症性皮疹数(個) | 平均値±標準偏差 | 30.2±10.7 |
| 中央値(最小値、最大値) | 30.0(10、50) | |
| ベースラインの紅色丘疹数(個) | 平均値±標準偏差 | 17.5±5.7 |
| 中央値(最小値、最大値) | 15.0(9、31) | |
| ベースラインの膿疱数(個) | 平均値±標準偏差 | 1.9±3.1 |
| 中央値(最小値、最大値) | 1.0(0、18) | |
| ベースラインのIGA、例数(%) | 0:皮疹なし | 0(0) |
| 1:ほぼ皮疹なし | 4(9.5) | |
| 2:軽度 | 19(45.2) | |
| 3:中等度 | 19(45.2) | |
| 4:重度 | 0(0) | |
| 評価部位、例数(%) | 胸部 | 2(4.8) |
| 背部 | 40(95.2) | |
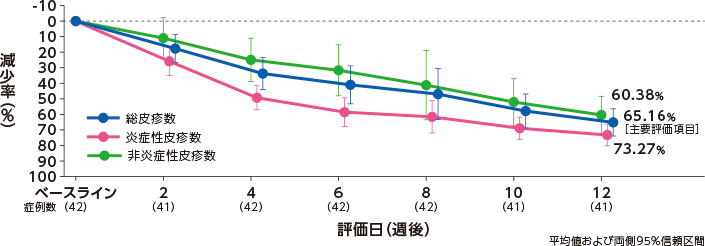
〔主要評価項目〕12週後の総皮疹数の減少率
〔副次評価項目〕各評価日の皮疹数の減少率の経時推移
治療開始12週後のベースラインからの総皮疹数の減少率(平均値)は、65.16%であった。
総皮疹数の減少率(平均値)は、2週後が17.68%、4週後が33.76%、6週後が41.01%であった。
炎症性皮疹数では、2週後が25.83%、4週後が49.30%、6週後が58.56%、12週後が73.27%であった。
非炎症性皮疹数では、2週後が10.95%、4週後が24.94%、6週後が31.66%、12週後が60.38%であった。
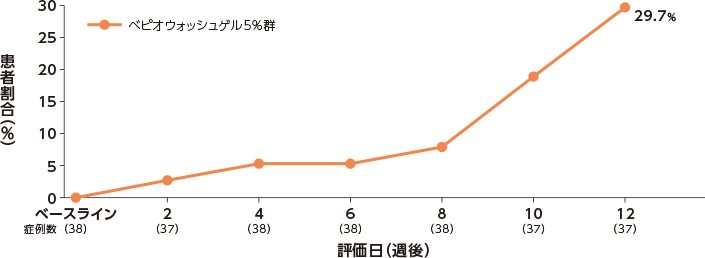
〔副次評価項目〕登録日と比較し、IGAが2段階以上改善かつ0または1になった患者の割合
登録日にIGAスコアが2以上の患者のうち、IGAスコアがベースラインから2段階以上改善かつ0または1になった患者の割 合は、2週後が2.7%、4週後が5.3%、6週後が5.3%、12週後が29.7%であった。
本試験における副作用
副作用は、42例中9例(21.4%)に認められた。
本試験において、重篤な副作用、投与中止に至った副作用および副作用による死亡例は認められなかった。
| ベピオウォッシュゲル5%群 | |
|---|---|
| 安全性解析対象症例数 | 42例 |
| 副作用発現症例数 | 9例(21.4%) |
| 一般・全身障害および投与部位の状態 | 5例(11.9%) |
| 適用部位紅斑 | 5例(11.9%) |
| 適用部位そう痒感 | 3例(7.1%) |
| 皮膚および皮下組織障害 | 5例(11.9%) |
| 皮膚剥脱 | 3例(7.1%) |
| 接触皮膚炎 | 1例(2.4%) |
| 皮脂欠乏症 | 1例(2.4%) |
| 臨床検査 | 1例(2.4%) |
| 白血球数増加 | 1例(2.4%) |
- 5. 効能・効果に関連する注意
- 結節及び嚢腫には、他の適切な処置を行うこと。
- 6. 用法・用量
- 1日1回、洗顔後、患部に適量を塗布し、5〜10分後に洗い流す。
- 8. 重要な基本的注意
-
- 8.1
- 全身性の過敏反応や重度の皮膚刺激症状が認められた場合は本剤の使用を中止すること。
- 8.2
- 本剤の使用中に皮膚剥脱(鱗屑・落屑)、紅斑、刺激感、腫脹等があらわれることがある。紅斑や腫脹が顔面全体や頚部にまで及ぶ症例も報告されているので、観察を十分に行い、異常が認められた場合には本剤の使用を中止するなど適切な処置を行うこと。
- 8.3
- 本剤の使用中には日光への曝露を最小限にとどめ、日焼けランプの使用、紫外線療法は避けること。
- 14. 適用上の注意
-
- 14.1
- 薬剤使用時の注意(抜粋)
- 14.1.1
- 本剤の有効成分濃度及び用法・用量は、過酸化ベンゾイル2.5%製剤と異なることに注意すること。



