顔面に尋常性ざ瘡を有する患者を対象とした第Ⅱ相臨床試験−用量設定試験−(M605106-03試験)
一部承認外の用法・用量の情報(10%過酸化ベンゾイル含有製剤の塗布)が含まれるが、用量探索を目的として実施され、本剤の承認時評価資料とされた試験であるため紹介する。なお、10%過酸化ベンゾイル含有製剤の塗布は承認外用量であるため、有効性の結果は削除し、安全性の結果のみを紹介する。
試験概要
社内資料(ベピオウォッシュゲル5% 顔面に尋常性ざ瘡を有する患者を対象とした第Ⅱ相臨床試験—用量設定試験—)[承認時評価資料]
- 目的
- 尋常性ざ瘡患者に対する治療として、5%または10%過酸化ベンゾイル含有製剤を塗布し、5~10分後に洗い流すショートコンタクトセラピーにより、顔面に1日1回12週間投与した際の有効性、安全性および至適濃度の検討
- 試験デザイン
- ランダム化、プラセボ対照、二重盲検、並行群間比較、多施設共同試験
- 対象
- 以下の基準を満たす12歳以上49歳以下の尋常性ざ瘡患者
- 顔面※1に11個以上40個以下の炎症性皮疹(紅色丘疹と膿疱)を伴う患者
- 顔面※1に20個以上100個以下の非炎症性皮疹(閉鎖面皰と開放面皰)を伴う患者
- 顔面※1の結節または嚢腫が2個以下の患者
- 方法
- 導入期間(治療開始前の2週間)にプラセボを塗布した後、以下の3群に患者を割り付け、試験薬をそれぞれ12週間塗布した。塗布方法は1日1回、顔面※1全体に適量塗布し、5〜10分後に洗い流した。
-
5%過酸化ベンゾイル含有製剤(本剤と生物学的に同等※2)群:過酸化ベンゾイルを5%含有する製剤を塗布
-
10%過酸化ベンゾイル含有製剤群:過酸化ベンゾイルを10%含有する製剤を塗布
-
プラセボ群:プラセボを塗布
-
- 解析対象
- 有効性および安全性
5%過酸化ベンゾイル含有製剤群:90例、10%過酸化ベンゾイル含有製剤群:88例、プラセボ群:91例 - 評価日
- 治療開始日※3、2、4、6、8、10、12週後または中止日
- 評価項目
-
- 1)
主要評価項目(検証的な解析項目):12週後の総皮疹数※4の減少率
- 2)
副次評価項目:各評価日の総皮疹数※4、炎症性皮疹数、非炎症性皮疹数の減少率の経時推移など
- 3)
安全性:有害事象、臨床検査値、皮膚安全性スコア(鱗屑、紅斑)
- 1)
- 解析計画
-
- 1)
有効性
FAS※5を対象に、投与群、評価時点および交互作用(投与群と評価時点)を説明変数とし、患者内誤差の分散共分散構造に無構造を仮定した混合効果モデル(MMRM)により、総皮疹数※4の減少率の最小二乗平均値、標準誤差、両側95%信頼区間を算出した。また、5%過酸化ベンゾイル含有製剤群または10%過酸化ベンゾイル含有製剤群とプラセボ群との差の最小二乗平均値、標準誤差、両側95%信頼区間およびp値を算出した。
主要評価項目である12週後の総皮疹数※4の減少率は以下の手順で群間比較をした。全体の有意水準を5%以下とするために、Hochberg法で多重性を調整した。なお、製剤群の用量間の検定は行わなかった。〈検定手順〉
- ①
5%過酸化ベンゾイル含有製剤群vs.プラセボ群、および10%過酸化ベンゾイル含有製剤群vs.プラセボ群のp値の大きい方が有意水準両側5%を下回った場合、5%過酸化ベンゾイル含有製剤群および10%過酸化ベンゾイル含有製剤群の両群でプラセボ群に対する優越性が検証されたと判断し、検定を終了した。p値が5%を上回った場合、②へ進んだ。
- ②
5%過酸化ベンゾイル含有製剤群vs.プラセボ群、および10%過酸化ベンゾイル含有製剤群vs.プラセボ群のp値の小さい方の用量の群が有意水準両側2.5%を下回った場合、当該用量の製剤群のプラセボ群に対する優越性が検証されたと判断した。
また、感度分析として、FAS※5を対象に欠測をLOCF※6で補完したもとで多重性の調整を除き、同様の解析を行った。
炎症性皮疹数および非炎症性皮疹数の減少率も多重性の調整を除き、総皮疹数※4の減少率と同様に解析した。 - ①
- 2)
安全性
安全性解析対象集団を対象に、有害事象はMedDRA/J(Ver.23.1)を用いて、器官別大分類(SOC)および基本語(PT)別に集計した。
- 1)
- 眼囲および口唇を除く
- 試験薬の処方が開発途中で変更されたため、本試験に用いた製剤は承認された本剤(ベピオウォッシュゲル5%)と異なるが、生物学的に同等である。
- 治療開始日をベースラインとした。
- 炎症性皮疹数と非炎症性皮疹数の合計
- Full analysis set(最大の解析対象集団):ランダム化後に試験薬を塗布し、有効性評価が行われた患者
- Last observation carried forward:評価時の値が得られていない症例について、直前値で補完する方法
患者背景
人口統計学的特性およびその他の基準値の特性(FAS)
| 5%過酸化ベンゾイル 含有製剤群 (n=90) |
10%過酸化ベンゾイル 含有製剤群 (n=88) |
プラセボ群 (n=91) |
||
|---|---|---|---|---|
| 性別、例数(%) | 男 | 51(56.7) | 46(52.3) | 45(49.5) |
| 女 | 39(43.3) | 42(47.7) | 46(50.5) | |
| 年齢、例数(%) | 12~15歳 | 29(32.2) | 24(27.3) | 25(27.5) |
| 16~20歳 | 31(34.4) | 25(28.4) | 29(31.9) | |
| 21~30歳 | 23(25.6) | 35(39.8) | 28(30.8) | |
| 31~40歳 | 5(5.6) | 3(3.4) | 3(3.3) | |
| 41~49歳 | 2(2.2) | 1(1.1) | 6(6.6) | |
| 平均値±標準偏差(歳) | 19.7±6.8 | 20.3±5.8 | 21.0±7.9 | |
| 前治療および併用薬剤、 例数(%) |
あり | 39(43.3) | 53(60.2) | 42(46.2) |
| なし | 51(56.7) | 35(39.8) | 49(53.8) | |
| 前治療および併用療法、 例数(%) |
あり | 3(3.3) | 3(3.4) | 1(1.1) |
| なし | 87(96.7) | 85(96.6) | 90(98.9) | |
| 治療期間の併用薬剤、 例数(%) |
あり | 39(43.3) | 53(60.2) | 42(46.2) |
| なし | 51(56.7) | 35(39.8) | 49(53.8) | |
| 治療期間の併用療法、 例数(%) |
あり | 1(1.1) | 3(3.4) | 2(2.2) |
| なし | 89(98.9) | 85(96.6) | 89(97.8) | |
| ベースラインの 総皮疹数(個) |
平均値±標準偏差 | 61.4±20.7 | 56.6±21.3 | 59.1±22.5 |
| 中央値(最小値、最大値) | 59.5(31、116) | 51.0(31、119) | 53.0(33、131) | |
| ベースラインの 炎症性皮疹数(個) |
平均値±標準偏差 | 19.8±7.7 | 18.2±6.7 | 19.6±7.5 |
| 中央値(最小値、最大値) | 17.0(11、39) | 17.0(11、40) | 17.0(11、38) | |
| ベースラインの 非炎症性皮疹数(個) |
平均値±標準偏差 | 41.5±18.7 | 38.3±18.7 | 39.5±19.5 |
| 中央値(最小値、最大値) | 35.0(20、91) | 31.5(20、92) | 33.0(21、98) | |
| ベースラインの 紅色丘疹数(個) |
平均値±標準偏差 | 16.1±6.5 | 14.4±5.8 | 16.0±5.9 |
| 中央値(最小値、最大値) | 15.0(4、34) | 13.5(0、35) | 14.0(5、33) | |
| ベースラインの 膿疱数(個) |
平均値±標準偏差 | 3.7±4.1 | 3.8±4.8 | 3.6±4.5 |
| 中央値(最小値、最大値) | 2.0(0、19) | 2.0(0、25) | 2.0(0、18) | |
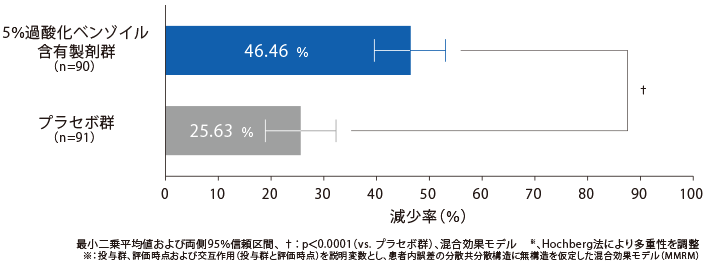
【主要評価項目:検証的な解析結果】12週後の総皮疹数の減少率
治療開始12週後のベースラインからの総皮疹数の減少率(最小二乗平均値)は、5%過酸化ベンゾイル含有製剤群46.46%であり、プラセボ群25.63%と比較して統計学的に有意な差が認められ、プラセボ群に対する5%過酸化ベンゾイル含有製剤群の優越性が検証された。
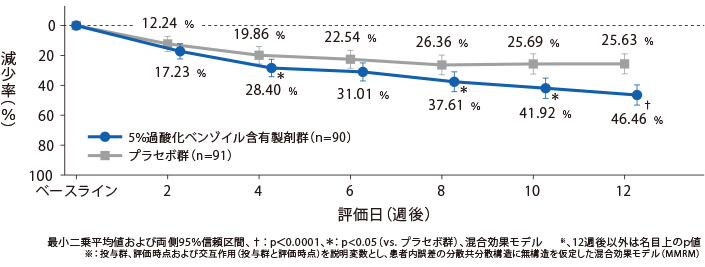
【副次評価項目】各評価日の総皮疹数の減少率の経時推移
5%過酸化ベンゾイル含有製剤群のベースラインからの総皮疹数の減少率(最小二乗平均値)は、2週後が17.23%、4週後が28.40%、6週後が31.01%、12週後が46.46%であった。
治療開始4週後および8週後以降において、プラセボ群と比較して統計学的に有意な差が認められた。
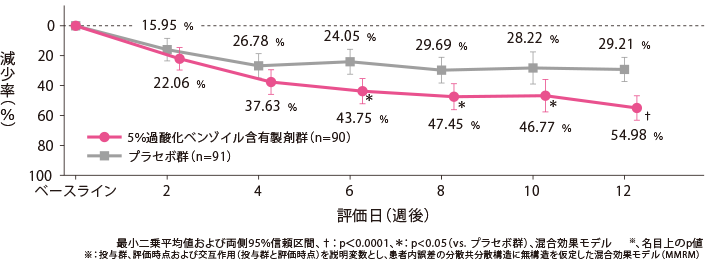
【副次評価項目】各評価日の非炎症性皮疹数の減少率の経時推移
5%過酸化ベンゾイル含有製剤群のベースラインからの非炎症性皮疹数の減少率(最小二乗平均値)は、2週後が13.15%、4週後が22.90%、6週後が23.35%、12週後が41.63%であった。
治療開始10週後以降において、プラセボ群と比較して統計学的に有意な差が認められた。
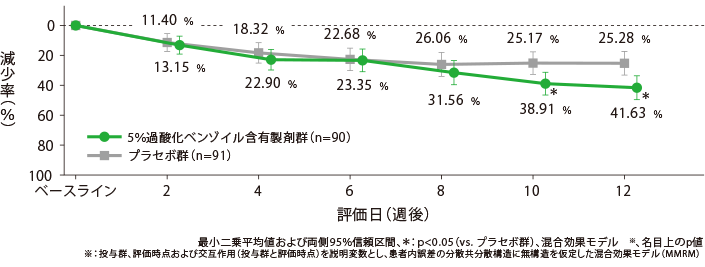
【副次評価項目】各評価日の非炎症性皮疹数の減少率の経時推移
5%過酸化ベンゾイル含有製剤群のベースラインからの非炎症性皮疹数の減少率(最小二乗平均値)は、2週後が13.15%、4週後が22.90%、6週後が23.35%、12週後が41.63%であった。
治療開始10週後以降において、プラセボ群と比較して統計学的に有意な差が認められた。
本試験における副作用
副作用は、5%過酸化ベンゾイル含有製剤群で90例中8例(8.9%)、10%過酸化ベンゾイル含有製剤群で88例中14例(15.9%)、プラセボ群で91例中5例(5.5%)に認められた。
投与中止に至った副作用は、5%過酸化ベンゾイル含有製剤群で適用部位紅斑および皮膚剥脱が1例、10%過酸化ベンゾイル含有製剤群で適用部位紅斑、接触皮膚炎が各1例に認められた。
本試験において、重篤な副作用および副作用による死亡例は認められなかった。
| 5%過酸化ベンゾイル 含有製剤群 |
10%過酸化ベンゾイル 含有製剤群 |
プラセボ群 | |
|---|---|---|---|
| 安全性解析対象症例数 | 90例 | 88例 | 91例 |
| 副作用発現症例数 | 8例(8.9%) | 14例(15.9%) | 5例(5.5%) |
| 皮膚および皮下組織障害 | 4例(4.4%) | 4例(4.5%) | 2例(2.2%) |
| ざ瘡 | 1例(1.1%) | 0例(0%) | 0例(0%) |
| 皮膚剥脱 | 2例(2.2%) | 1例(1.1%) | 1例(1.1%) |
| 接触皮膚炎 | 0例(0%) | 2例(2.3%) | 0例(0%) |
| アトピー性皮膚炎 | 1例(1.1%) | 1例(1.1%) | 0例(0%) |
| 皮膚萎縮 | 0例(0%) | 0例(0%) | 1例(1.1%) |
| 一般・全身障害および投与部位の状態 | 6例(6.7%) | 11例(12.5%) | 5例(5.5%) |
| 適用部位紅斑 | 3例(3.3%) | 7例(8.0%) | 1例(1.1%) |
| 適用部位刺激感 | 3例(3.3%) | 4例(4.5%) | 1例(1.1%) |
| 適用部位乾燥 | 0例(0%) | 0例(0%) | 3例(3.3%) |
| 適用部位そう痒感 | 0例(0%) | 1例(1.1%) | 0例(0%) |
| 眼障害 | 1例(1.1%) | 0例(0%) | 0例(0%) |
| 眼瞼紅斑 | 1例(1.1%) | 0例(0%) | 0例(0%) |
- 5. 効能・効果に関連する注意
- 結節及び嚢腫には、他の適切な処置を行うこと。
- 6. 用法・用量
- 1日1回、洗顔後、患部に適量を塗布し、5〜10分後に洗い流す。
- 8. 重要な基本的注意
-
- 8.1
- 全身性の過敏反応や重度の皮膚刺激症状が認められた場合は本剤の使用を中止すること。
- 8.2
- 本剤の使用中に皮膚剥脱(鱗屑・落屑)、紅斑、刺激感、腫脹等があらわれることがある。紅斑や腫脹が顔面全体や頚部にまで及ぶ症例も報告されているので、観察を十分に行い、異常が認められた場合には本剤の使用を中止するなど適切な処置を行うこと。
- 8.3
- 本剤の使用中には日光への曝露を最小限にとどめ、日焼けランプの使用、紫外線療法は避けること。
- 14. 適用上の注意
-
- 14.1
- 薬剤使用時の注意(抜粋)
- 14.1.1
- 本剤の有効成分濃度及び用法・用量は、過酸化ベンゾイル2.5%製剤と異なることに注意すること。



