ベピオゲル2.5%の尋常性ざ瘡患者を対象とした長期投与時(52週間)の第Ⅲ相臨床試験
本試験は、一部承認外(過酸化ベンゾイル5%ゲル製剤)の成績が含まれるが、本試験成績をもとに承認されたため紹介する。
試験概要
- 試験デザイン
- ランダム化、非盲検、多施設共同試験
- 対象
- 以下の基準を満たす12歳以上50歳未満の尋常性ざ瘡患者
- 顔面※1に5個以上40個以下(細菌学的検査のために採取した膿疱を除く)の炎症性皮疹(紅色丘疹と膿疱)を伴う患者
- 顔面※1に1個以上100個以下の非炎症性皮疹(閉鎖面皰と開放面皰)を伴う患者
- 顔面※1の結節または嚢腫が2個以下の患者
- 方法
- 割り付けられた以下の試験薬を適量1日1回(夜)洗顔後に水分をよく拭き取った後、顔面※1全体に52週間塗布した※2。
- 試験薬:
ベピオゲル2.5%
BPOゲル5%(過酸化ベンゾイル5%ゲル製剤)
- 試験薬:
- 有効性および
安全性解析対象 - ベピオゲル2.5%群:231例、BPOゲル5%群:227例
- 評価日
- 治療開始日、2、4、8、12、16、20、24、28、32、36、40、44、48、52週後または中止日
- 評価項目
-
- 各評価日の総皮疹数(炎症性皮疹数※3と非炎症性皮疹数の合計)、炎症性皮疹数および非炎症性皮疹数の減少率・減少数・皮疹数の経時推移
- 細菌学的検査
- 安全性(有害事象、臨床検査値、皮膚安全性スコア)
- 解析計画
-
- 1)
有効性
有効性解析対象集団を対象に、投与群・評価時期ごとの要約統計量および95%信頼区間を算出した。 - 2)
安全性
副作用は、安全性解析対象集団を対象に、因果関係別・投与群別に発現例数および発現割合を算出した。また、副作用の発現時期ごとに因果関係別の発現例数および発現割合を算出した。
皮膚安全性スコアは、投与群別・評価時期別に要約統計量を算出し、投与群別・評価時期別に各スコアの頻度分布を求めた。
- 1)
承認された製剤は2.5%ゲル剤である(ゲル剤1g中に過酸化ベンゾイル25mg含有)。
BPOゲル5%群の有効性は承認外であるため紹介していない。
- 眼囲および口唇を除く
- 皮疹消失後も、試験担当医師により顔面※2 の炎症性皮疹および非炎症性皮疹が完全に消失したと判断されるまでは塗布を継続した
- 皮疹数として細菌学的検査のために採取した膿疱を治療開始日は除き、52週後(または中止日)は含めた
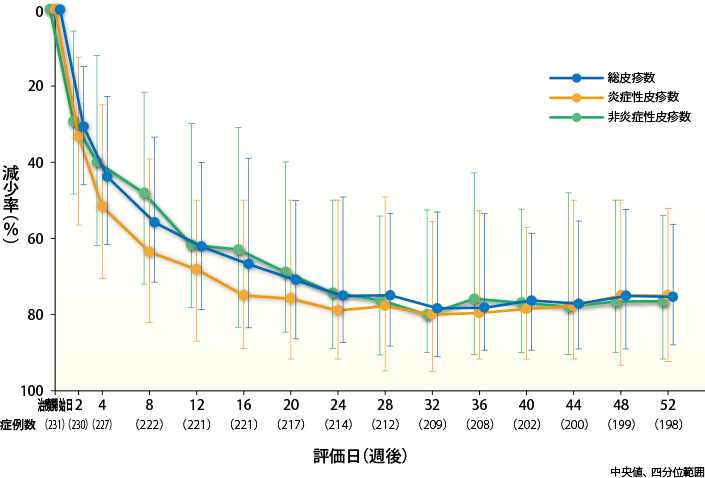
皮疹数の減少率の経時推移
総皮疹数
ベピオゲル2.5%群の総皮疹数の減少率(中央値)は、2週後30.6%、4週後43.8%、8週後55.7%、12週後62.1%と経時的に推移し、それ以降も総皮疹数の減少率は維持され、52週後は75.3%であった。
炎症性皮疹数
ベピオゲル2.5%群の炎症性皮疹数の減少率(中央値)は、2週後33.3%、4週後51.7%、8週後63.6%、12週後68.2%と経時的に推移し、それ以降も炎症性皮疹数の減少率は維持され、52週後は75.0%であった。
非炎症性皮疹数
ベピオゲル2.5%群の非炎症性皮疹数の減少率(中央値)は、2週後29.3%、4週後40.0%、8週後48.2%、12週後61.8%と経時的に推移し、それ以降も非炎症性皮疹数の減少率は維持され、52週後は76.6%であった。
本試験における副作用
副作用は、ベピオゲル2.5%群で231例中114例(49.4%)、BPOゲル5%群で227例中125例(55.1%)に認められた。
投与中止に至った副作用は、ベピオゲル2.5%群で接触性皮膚炎(3例)、適用部位刺激感(1例)、適用部位蕁麻疹(1例)、紅斑(1例)、BPOゲル5%群で適用部位刺激感(3例)、接触性皮膚炎(3例)、適用部位紅斑(2例)、適用部位そう痒感(1例)、皮膚炎(1例)、アレルギー性皮膚炎(1例)が認められた。本試験において、重篤な副作用および副作用による死亡例は認められなかった。
主な副作用(いずれかの群で発現率2%以上)
| ベピオゲル2.5%群 | BPOゲル5%群 | |
|---|---|---|
| 安全性解析対象症例数 | 231例 | 227例 |
| 適用部位刺激感 | 44例(19.0%) | 46例(20.3%) |
| 皮膚剥脱 | 42例(18.2%) | 53例(23.3%) |
| 適用部位紅斑 | 32例(13.9%) | 41例(18.1%) |
| 適用部位乾燥 | 30例(13.0%) | 38例(16.7%) |
| 適用部位そう痒感 | 14例(6.1%) | 13例(5.7%) |
| 接触性皮膚炎 | 7例(3.0%) | 4例(1.8%) |
川島眞ら:臨床医薬,30(8),669(2014)(承認時評価資料)
本試験は、マルホ株式会社の資金により行われた。
本論文の著者には、マルホ株式会社の社員が含まれる。
- 4. 効能・効果
- 尋常性ざ瘡
- 5. 効能・効果に関連する注意
- 結節及び嚢腫には、他の適切な処置を行うこと。
- 6. 用法・用量
- 1日1回、洗顔後、患部に適量を塗布する。
- 8. 重要な基本的注意
-
- 8.1
- 全身性の過敏反応や重度の皮膚刺激症状が認められた場合は本剤の使用を中止すること。
- 8.2
- 本剤の使用中に皮膚剥脱(鱗屑・落屑)、紅斑、刺激感、腫脹等があらわれることがある。紅斑や腫脹が顔面全体や頚部にまで及ぶ症例も報告されているので、観察を十分に行い、異常が認められた場合には本剤の使用を中止するなど適切な処置を行うこと。
- 8.3
- 本剤の使用中には日光への曝露を最小限にとどめ、日焼けランプの使用、紫外線療法は避けること。



