国内第Ⅱ相・第Ⅲ相臨床試験における疾患別有効性・菌陰性化率・剤形別安全性
試験概要1-5)
対象
総計1,457例*
*:前期第II相臨床試験において、承認用法・用量を逸脱した症例(クリームを1日2回塗布した指間びらん症患者3例)が含まれていたため、これら3例を除いて再集計した結果を示す。
投与期間
足白癬、カンジダ性爪囲炎は4週間、その他の疾患は2週間
投与方法
1日1回、患部に適量を塗布
評価基準
皮膚所見
各観察日にそう痒、発赤、鱗屑、びらん等の臨床症状について観察し、高度、中等度、軽度、なしの4段階で評価した。
皮膚所見の総合判定
皮膚所見の推移を考慮して著明改善、改善、やや改善、不変、悪化の5段階で評価した。
有効性
皮膚所見の総合判定と真菌学的検査(直接鏡検)の結果を総合的に考慮して著効、有効、やや有効、無効、悪化の5段階で評価した。
安全性
有害事象、副作用、臨床検査値異常
疾患別有効性・菌陰性化率1-5)
アスタットクリーム1%
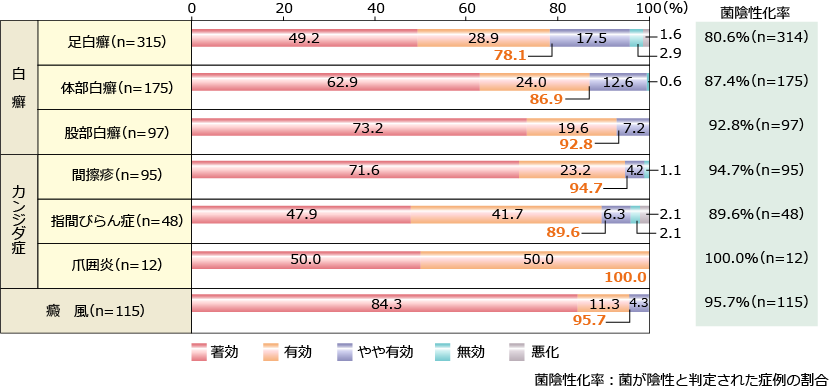
社内集計
アスタット外用液1%
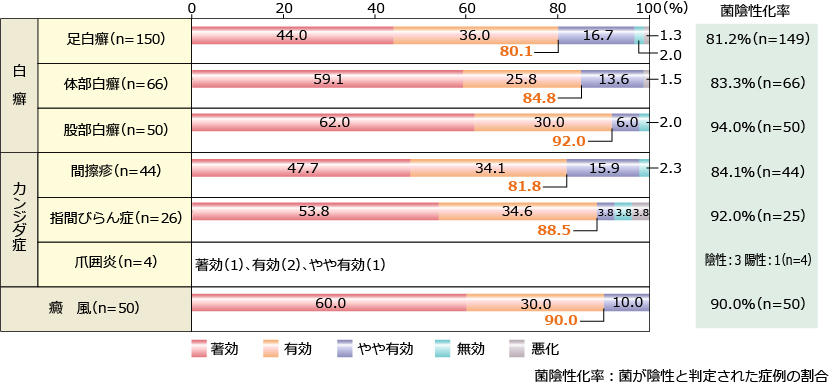
社内集計
アスタット軟膏1%
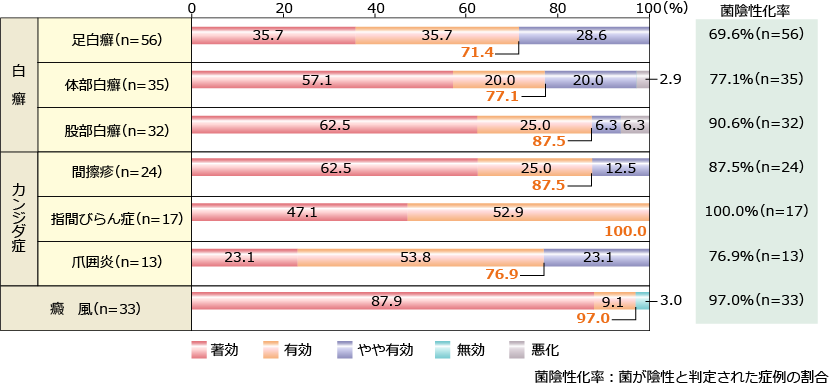
社内集計
剤形別安全性1-5)
アスタットクリーム1%
承認時までの臨床試験において、副作用は978例中9例(0.9%)12件に認められ、投与中止に至った症例が11例あった。主な副作用は接触性皮膚炎4件(0.4%)の他、乾燥、小水疱、発赤、びらん等であった。臨床検査値の異常変動としては、AST(GOT)、ALT(GPT)上昇が249例中各1件(0.4%)、BUN上昇が244例中1件(0.4%)に認められた。本試験において重篤な有害事象は認められなかった。
アスタット外用液1%
承認時までの臨床試験において、副作用は465例中10例(2.2%)11件に認められ、投与中止に至った症例が6例あった。主な副作用は刺激感6件(1.3%)、接触性皮膚炎2件(0.4%)の他、発赤、そう痒、角化の悪化等であった。臨床検査値の異常変動としては、AST(GOT)上昇が115例中1件(0.9%)に認められた。本試験において重篤な有害事象は認められなかった。
アスタット軟膏1%
承認時までの臨床試験において、副作用は245例中4例(1.6%)4件に認められ、投与中止に至った症例が2例あった。接触性皮膚炎3件(1.2%)、刺激感1件(0.4%)であった。本試験において重篤な有害事象は認められなかった。
- TJN-318クリーム研究班:西日本皮膚科, 54(5), 954, 1992(承認時評価資料)
- TJN-318クリーム研究班:西日本皮膚科, 54(5), 962, 1992(承認時評価資料)
- TJN-318クリーム研究班:西日本皮膚科, 54(5), 977, 1992(承認時評価資料)
- TJN-318液剤研究班:西日本皮膚科, 54(5), 944, 1992(承認時評価資料)
- ラノコナゾール軟膏剤研究会:西日本皮膚科, 57(4), 829, 1995(承認時評価資料)



