アメナリーフの帯状疱疹患者を対象とした第Ⅲ相二重盲検並行群間比較試験<非劣性試験>
試験概要
目的
帯状疱疹患者に対するアメナリーフの有効性及び安全性について、バラシクロビル塩酸塩を対照に検討する。
試験デザイン
実薬対照、ランダム化(層別割付)、二重盲検、ダブルダミー、並行群間比較、多施設共同試験
対象
20歳以上80歳未満、皮疹発現後72時間以内の帯状疱疹患者
| アメナリーフ | バラシクロビル 塩酸塩群 |
計 | ||
|---|---|---|---|---|
| 400mg群 | 200mg群 注) | |||
| ランダム化された症例 | 250例 | 252例 | 249例 | 751例 |
| 有効性解析対象(FAS) | 243例 | 247例 | 245例 | 735例 |
| 安全性解析対象 | 249例 | 252例 | 249例 | 750例 |
用法・用量及び投与期間
- アメナリーフ群:アメナメビルとして400mg又は200mg注)を1日1回食後(朝食後)、7日間経口投与
- バラシクロビル塩酸塩群:バラシクロビル塩酸塩1回1000mgを1日3回(毎食後)、7日間経口投与
両群ともに、朝食後、昼食後、夕食後の1日3回7日間、プラセボを含めて1回4錠となるように投与した。
なお、下記表の薬剤及び療法は併用を禁止又は制限した。CYP3A4で代謝を受ける薬剤(経口避妊薬、免疫抑制剤は除く)は、有害事象の発現等に十分注意し使用することで併用可能とした。
| 期間 | 併用禁止薬剤・療法等 | 併用制限薬剤 |
|---|---|---|
| 同意取得日から92日目又は中止来院日1もしくは3まで | NSAIDs外用剤及びステロイド(病変部位以外への局所使用は可とした)、プレガバリンなど帯状疱疹の疼痛緩和を目的とした薬剤、ライ症候群を発症する可能性のある全身投与医薬品、病変部位への光線療法、神経ブロック、イオントフォレーシス、レーザー療法、低周波療法、温熱療法等 | 坐剤以外の外用剤を除くアセトアミノフェン及びNSAIDs(帯状疱疹による疼痛緩和を目的として治験薬投与期間中は同一条件で使用し減量若しくは中止、頓服は可とした)、鎮痛薬を含む感冒用配合剤及び市販の解熱鎮痛剤(有害事象の対処のための原則3日以内の一時的使用は可とした) |
| 同意取得日から29日目又は中止来院日1まで | 抗ウイルス薬(抗インフルエンザ薬を除く)、免疫グロブリン製剤、消毒剤を含む病変部位へのすべての外用剤(白色ワセリンのみ使用は可とした) | - |
| 治験薬投与期間中及び投与終了日より7日間 | 経口避妊薬、免疫抑制剤 | - |
| 治験薬投与期間中 |
CYP3A4を阻害する薬剤(マクロライド系抗生物質、アゾール系抗真菌剤、HIVプロテアーゼ阻害剤、その他)、及び飲食物(グレープフルーツ及びスウィーティー)、CYP3A4を誘導する薬剤(抗てんかん剤、抗生物質、その他)、及び飲食物[セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品]、QT延長をきたすおそれのある薬剤(局所使用は可とした)、バラシクロビル及びアシクロビルの添付文書で併用注意と記載されている薬剤 |
- |
- 注)アメナリーフ200mg群は承認外用量のため、結果は未記載。
評価項目
有効性の評価項目
- 主要評価項目:治験薬投与開始4日目までの新皮疹形成停止率(新皮疹形成停止が認められた患者の割合)(検証的解析項目)
- 副次評価項目:新皮疹形成停止までの日数、完全痂皮化までの日数、治癒までの日数、疼痛消失までの日数、ウイルス消失までの日数
- サブグループ解析:皮疹発現から投与開始までの時間別にみた投与開始4日目までの新皮疹形成停止率など
安全性の評価項目
有害事象(自覚症状及び他覚所見、臨床検査値の異常変動、バイタルサインの異常変動及び心電図の異常所見)、臨床検査値、バイタルサイン及び心電図
解析計画
主要評価項目
各群の患者の割合ならびに群間の割合の差及びその両側95%信頼区間※1を算出し、バラシクロビル塩酸塩群に対するアメナリーフ400mg群の非劣性についてFarrington-Manning法をMantel-Haenszel型の調整に拡張した検定を用いて閉手順で検証した。なお、片側P 値が0.025より小さい場合に非劣性と判断することとした。層別因子は年齢(65歳未満、65歳以上)及び皮疹発現から投与開始までの時間(24時間以下、24時間超48時間以下、48時間超72時間以下)、非劣性マージンは10%と設定した。
バラシクロビル塩酸塩群に対するアメナリーフ400mg群及び200mg群注)の非劣性の検証手順
| ステップ | 評価項目 |
|---|---|
| 1 | 【主要評価項目】バラシクロビル塩酸塩群に対するアメナリーフ400mg群の非劣性の検定を行った。 |
| 2 | ステップ1で非劣性が検証された場合のみ、バラシクロビル塩酸塩群に対するアメナリーフ200mg群注)の非劣性の検定を行うこととした。 |
バラシクロビル塩酸塩群に対するアメナリーフ200mg群の非劣性は検証されず、検定手順は終了した。
※1 層別因子により調整したMantel-Haenszel型の信頼区間
注)アメナリーフ200mg群は承認外用量のため、結果は未記載。
副次評価項目
各項目をイベントとし、Kaplan-Meier法によりデータを要約するとともに、皮疹発現から投与開始までの時間を層とした層別Cox比例ハザード回帰分析による群間のハザード比及びその両側95%信頼区間を算出した。
サブグループ解析
年齢及び皮疹発現から投与開始までの時間が、主要評価項目の層別因子として事前に設定された。
有効性
主要評価項目 治験薬投与開始4日目までの新皮疹形成停止率(FAS)(検証的解析結果)
治験薬投与開始4日目までの新皮疹形成停止率は、アメナリーフ400mg群81.1%(197/243例)、バラシクロビル塩酸塩群75.1%(184/245例)でした。アメナリーフ400mg群とバラシクロビル塩酸塩群の差の推定値[両側95%信頼区間]は7.1%[−0.2~14.4%]であり、アメナリーフ400mg群のバラシクロビル塩酸塩群に対する非劣性が検証されました (非劣性マージン:10%、P <0.0001、Farrington-Manning法をMantel-Haenszel型の調整に拡張した非劣性の検定)。
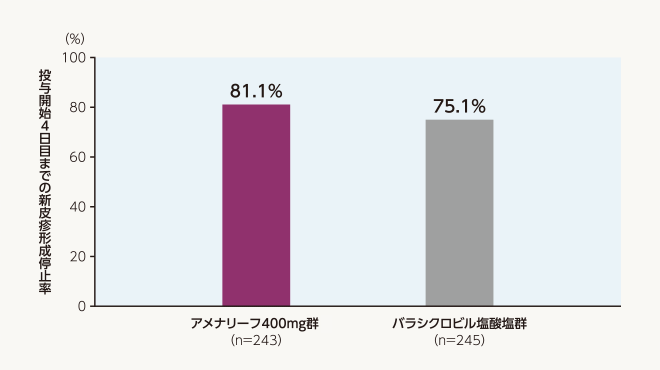
| 投与群 | 投与開始4日目までの 新皮疹形成停止率 |
バラシクロビル塩酸塩群との群間差 [95%信頼区間]※2 |
P 値※3 |
|---|---|---|---|
| アメナリーフ 400mg群 |
81.1% (197/243例) |
7.1% [−0.2~14.4%] |
<0.0001 |
| バラシクロビル 塩酸塩群 |
75.1% (184/245例) |
- | - |
- ※2 層別因子で調整したMantel-Haenszel型の信頼区間
- ※3 Farrington-Manning法をMantel-Haenszel型の調整に拡張した非劣性の検定
副次評価項目 新皮疹形成停止までの日数(FAS)
新皮疹形成停止までの日数の中央値は、アメナリーフ400mg群、バラシクロビル塩酸塩群ともに4日でした。層別Cox比例ハザード回帰分析によるバラシクロビル塩酸塩群に対するアメナリーフ400mg群のハザード比の推定値[両側95%信頼区間]は1.06[0.88~1.28]でした。
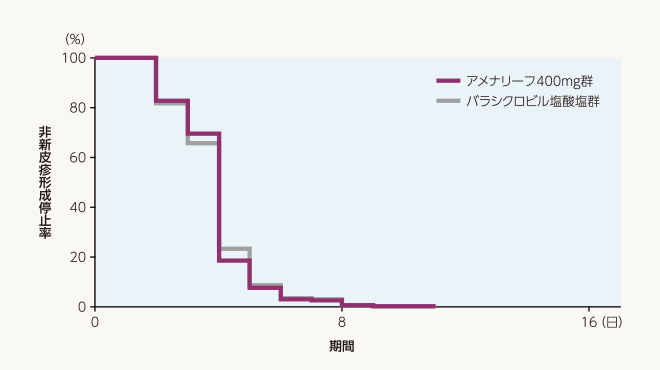
| 投与群 | 評価例数 | 打ち切り 例数 |
新皮疹形成停止までの日数(日) | ハザード比 [95%信頼区間] |
||
|---|---|---|---|---|---|---|
| 25%点 | 中央値 | 75%点 | ||||
| アメナリーフ 400mg群 |
243 | 8 | 3 | 4 | 4 | 1.06 [0.88~1.28] |
| バラシクロビル 塩酸塩群 |
245 | 6 | 3 | 4 | 4 | - |
- 層別Cox比例ハザード回帰分析
副次評価項目 完全痂皮化までの日数(FAS)
完全痂皮化までの日数の中央値は、アメナリーフ400mg群9日、バラシクロビル塩酸塩群8日でした。層別Cox比例ハザード回帰分析によるバラシクロビル塩酸塩群に対するアメナリーフ400mg群のハザード比の推定値[両側95%信頼区間]は0.99[0.82~1.20]でした。
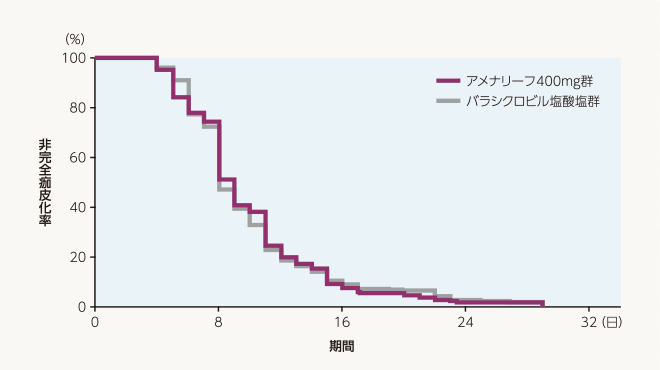
| 投与群 | 評価例数 | 打ち切り 例数 |
完全痂皮化までの日数(日) | ハザード比 [95%信頼区間] |
||
|---|---|---|---|---|---|---|
| 25%点 | 中央値 | 75%点 | ||||
| アメナリーフ 400mg群 |
243 | 25 | 7 | 9 | 11 | 0.99 [0.82~1.20] |
| バラシクロビル 塩酸塩群 |
245 | 20 | 7 | 8 | 11 | - |
- 層別Cox比例ハザード回帰分析
副次評価項目 治癒までの日数(FAS)
治癒するまでの日数の中央値は、アメナリーフ400mg群、バラシクロビル塩酸塩群ともに11日でした。層別Cox比例ハザード回帰分析によるバラシクロビル塩酸塩群に対するアメナリーフ400mg群のハザード比の推定値[両側95%信頼区間]は1.02[0.84~1.23]でした。
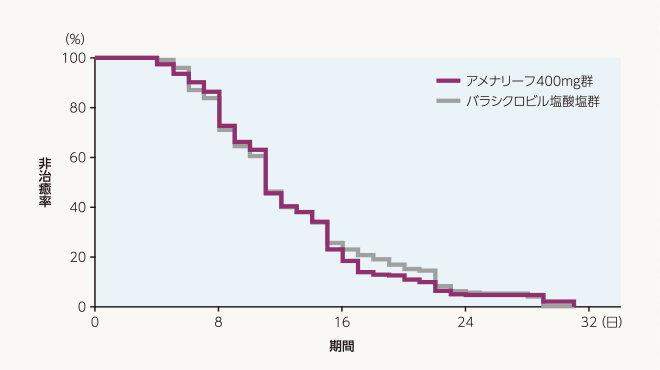
| 投与群 | 評価例数 | 打ち切り 例数 |
治癒までの日数(日) | ハザード比 [95%信頼区間] |
||
|---|---|---|---|---|---|---|
| 25%点 | 中央値 | 75%点 | ||||
| アメナリーフ 400mg群 |
243 | 33 | 8 | 11 | 15 | 1.02 [0.84~1.23] |
| バラシクロビル 塩酸塩群 |
245 | 21 | 8 | 11 | 16 | - |
- 層別Cox比例ハザード回帰分析
副次評価項目 疼痛消失までの日数(FAS)
疼痛消失までの日数の中央値は、アメナリーフ400mg群、バラシクロビル塩酸塩群ともに10日でした。層別Cox比例ハザード回帰分析によるバラシクロビル塩酸塩群に対するアメナリーフ400mg群のハザード比の推定値[両側95%信頼区間]は1.07[0.87~1.30]でした。
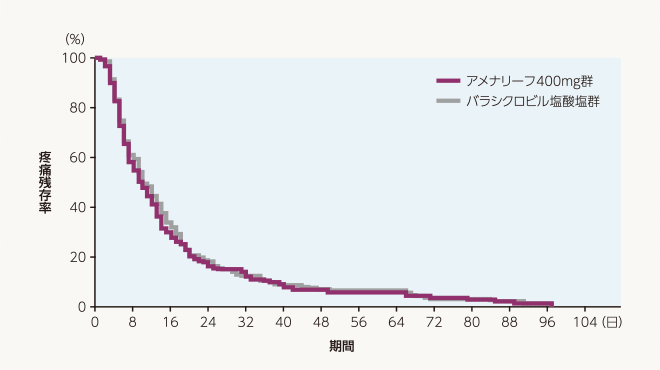
| 投与群 | 評価例数 | 打ち切り 例数 |
疼痛消失までの日数(日) | ハザード比 [95%信頼区間] |
||
|---|---|---|---|---|---|---|
| 25%点 | 中央値 | 75%点 | ||||
| アメナリーフ 400mg群 |
243 | 26 | 5 | 10 | 19 | 1.07 [0.87~1.30] |
| バラシクロビル 塩酸塩群 |
245 | 19 | 5 | 10 | 19 | - |
- 層別Cox比例ハザード回帰分析
副次評価項目 ウイルス消失までの日数(FAS)
ウイルス消失までの日数の中央値は、アメナリーフ400mg群5日、バラシクロビル塩酸塩群4日でした。層別Cox比例ハザード回帰分析によるバラシクロビル塩酸塩群に対するアメナリーフ400mg群のハザード比の推定値[両側95%信頼区間]は0.92[0.69~1.23]でした。
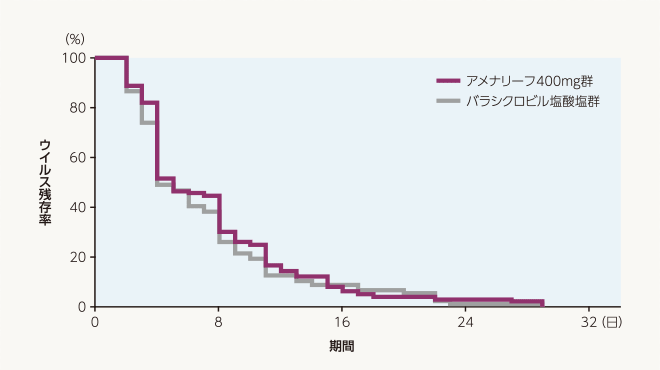
| 投与群 | 評価例数 | 打ち切り 例数 |
ウイルス消失までの日数(日) | ハザード比 [95%信頼区間] |
||
|---|---|---|---|---|---|---|
| 25%点 | 中央値 | 75%点 | ||||
| アメナリーフ 400mg群 |
243 | 5 | 4 | 5 | 10 | 0.92 [0.69~1.23] |
| バラシクロビル 塩酸塩群 |
245 | 3 | 3 | 4 | 9 | - |
- 層別Cox比例ハザード回帰分析
サブグループ解析 投与開始までの時間別にみた投与開始4日目までの新皮疹形成停止率
アメナリーフ400mg群における、皮疹出現から初回投与までの時間別にみた投与開始4日目までの新皮疹形成停止率は、24時間以下が75.0%、24時間超48時間以下が82.7%、48時間超72時間以下が83.1%でした。
| 初回投与までの時間 | 投与開始4日目までの 新皮疹形成停止率 |
群間の割合の差 (アメナリーフ400mg群ー バラシクロビル塩酸塩群) |
|
|---|---|---|---|
| アメナリーフ 400mg群 |
バラシクロビル 塩酸塩群 |
差の推定値 [95%信頼区間]※4 |
|
| 24時間以下 | 75.0% (42/56例) |
53.3% (24/45例) |
21.7% [3.0~40.3%] |
| 24時間超 48時間以下 |
82.7% (81/98例) |
75.8% (69/91例) |
6.8% [-4.7~18.4%] |
| 48時間超 72時間以下 |
83.1% (74/89例) |
83.5% (91/109例) |
-0.3% [-10.8~10.1%] |
- ※4 Farrington-Manning信頼区間
本試験における副作用※ (安全性解析対象集団)
- ※ 治験薬に関連のある有害事象を副作用として取り扱った。
臨床検査値異常を含む副作用は、アメナリーフ400mg群で249例中25例(10.0%)、バラシクロビル塩酸塩群で249例中30例(12.0%)に認められました。アメナリーフ400mg群の主な副作用は、フィブリン分解産物増加5例(2.0%)、心電図QT延長4例(1.6%)、β-NアセチルDグルコサミニダーゼ増加3例(1.2%)、α1ミクログロブリン増加3例(1.2%)等でした。バラシクロビル塩酸塩群の主な副作用は、フィブリン分解産物増加6例(2.4%)、α1ミクログロブリン増加4例(1.6%)、下痢3例(1.2%)、尿中蛋白陽性3例(1.2%)等でした。アメナリーフ400mg群において、死亡例を含む重篤な副作用及び投与中止に至った副作用は認められませんでした。バラシクロビル塩酸塩群において、投与中止に至った副作用として腹痛及び肝機能異常が1例、脳症が1例に認められ、投与中止後回復しました。
- 注)アメナリーフ200mg群は承認外用量のため、結果は未記載
- 6. 用法・用量(一部抜粋)
- 〈帯状疱疹〉
通常、成人にはアメナメビルとして1回400mgを1日1回食後に経口投与する。 - 7. 用法・用量に関連する注意(一部抜粋)
- 〈効能共通〉
- 7.1
- 空腹時に投与するとアメナメビルの吸収が低下し、効果が減弱するおそれがあるので、食後に服用するよう患者に指導すること。食前又は食間のタイミングで服用する必要がある場合は、軽食等を摂取した上で服用させること。[16.2.1参照]
- 7.2
- 本剤の投与は、発病初期に近いほど効果が期待できるので、早期に投与を開始すること。なお、目安として皮疹出現後5日以内に投与を開始することが望ましい。
- 7.3
- 本剤は、原則として7日間使用すること。改善の兆しが見られないか、あるいは悪化する場合には、速やかに他の治療に切り替えること。
社内資料:帯状疱疹患者を対象とした第Ⅲ相臨床試験(M522101-J01試験)(承認時評価資料)



