アメナリーフの再発性の性器ヘルペス患者を対象とした第Ⅲ相二重盲検比較試験<優越性試験>
● 本試験で一部承認外の用量の成績が含まれるが、再発性の単純疱疹の効能・効果及び用法・用量は本試験をもとに承認されたため、紹介する。
試験概要
目的
再発性の性器ヘルペス患者を対象に、アメナメビルとして1200mgを早期短期治療により1回服用した際の有効性を検証し、安全性を評価した。
試験デザイン
プラセボ対照、ランダム化、二重盲検、並行群間比較、多施設共同試験
対象
以下をすべて満たす再発性の性器ヘルペス患者
- 18歳以上80歳未満
- 再発性の性器ヘルペスを経験しており、再発の初期症状を正確に判断できると治験責任医師又は治験分担医師が認めた場合
- ウイルス抗体検査で抗HSV抗体が陽性
| アメナリーフ群 | プラセボ群 | 計注) | ||
|---|---|---|---|---|
| ランダム化された症例 | 292例 | 286例 | 578例 | |
| 有効性解析対象 | ITT | 124例 | 140例 | 264例 |
| mITT | 89例 | 97例 | 186例 | |
| 安全性解析対象 | 124例 | 140例 | 264例 | |
ITT:Intention to Treat、mITT:modified ITT(解析計画を参照)
注)本試験データは、用法・用量を逸脱した症例(低用量)を含む。
用法・用量
アメナリーフ群:アメナメビルとして1200mg(200mg×6錠)、食後単回経口投与
プラセボ群:プラセボ(6錠)、食後単回経口投与
方法
患者はPIT※1として、再発の初期症状発現後6時間以内に、アメナリーフ又はプラセボを食後に1回服用した。ただし、以下のいずれかに該当する場合は服用しないこととした。
- 再発の初期症状発現後、6時間を超えている
- 再発の初期症状が、過去に生じた症状と異なる
- 治験薬服用後に規定来院ができないことが判明している
- 併用禁止薬剤の使用、併用禁止療法等を行った場合
なお、以下の薬剤及び療法は併用禁止とした。
| 期間 | 併用禁止薬剤・療法等 |
|---|---|
| 治験薬服用14日前から 治験薬服用2日後まで |
CYP3Aを誘導する薬剤(抗生物質、抗てんかん剤、その他)、又は飲食物[セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品] (局所投与医薬品の使用は可とした) |
| 治験薬服用14日前から 完了/中止来院日1の診察時まで |
抗ウイルス薬(抗インフルエンザ薬の使用は可とした)、ステロイド薬、免疫抑制薬、インターフェロン、γ-グロブリン製剤 [性器ヘルペスの病変部位(好発部位)以外に対する局所投与医薬品の使用は可とした] |
| 再発の初期症状発現時点から 治験薬服用2日後まで |
CYP3Aを阻害する薬剤(マクロライド系抗生物質、アゾール系抗真菌剤、HIVプロテアーゼ阻害剤、その他)、又は飲食物(グレープフルーツ等フラノクマリン類を多量に含む柑橘類) (局所投与医薬品の使用は可とした) |
| 再発の初期症状発現時点から 完了/中止来院日1の診察時まで |
性器ヘルペスの病変部位に対する局所投与医薬品(保湿剤、保護剤及び表面麻酔剤の使用は可とした)、及び性器ヘルペスの病変部位に対するすべての併用療法 |
※1 Patient Initiated Therapy:あらかじめ処方された薬剤を初期症状に基づき患者判断で服用を開始する治療方法
試験スケジュール
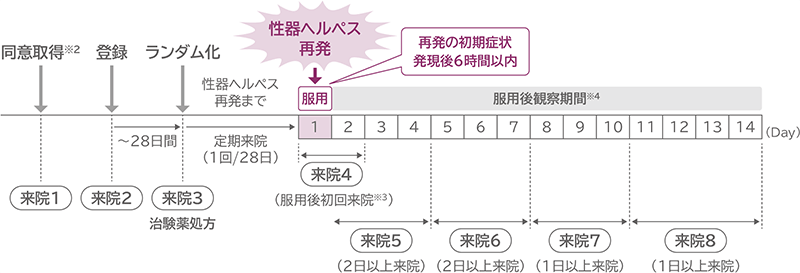
※2 同意取得日に登録可
※3 服用後Day1~2のうちに1回来院。初回来院日がDay2の場合、来院5の規定来院数の1回に含めた。
※4 完了基準に該当するまで。Day4以降に完了基準に該当した場合、当該来院日を完了来院日とした。
Day3以前に完了基準に該当した場合は、Day4以降に来院し、当該来院日を完了来院日とした。
評価項目
有効性の評価項目
その他の有効性評価項目:Aborted lesion症例のうち紅斑・丘疹ありの患者の割合(サブグループ解析)
※5 紅斑・丘疹より進行しなかった皮疹(再発の初期症状のみで、皮疹が発現しなかった場合も含む)
安全性の評価項目
有害事象(自覚症状及び他覚所見、臨床検査値異常変動)、臨床検査
解析計画
解析対象集団
ランダム化され治験薬を服用した症例をIntention to Treat(ITT)、ITTからAborted lesion症例、治験薬服用後の有効性に関するデータが全く得られていない症例、又は治験薬服用後に性器ヘルペスではないことが確認された症例のいずれかに該当する症例を除外した集団をmodified ITT(mITT)とし、mITTを有効性の主たる解析対象集団、ITTを安全性解析対象集団とした。
有効性
主要評価項目
mITTを対象に、Kaplan-Meier推定法によりデータを要約し、投与群を説明変数としたCox比例ハザード回帰分析を用いて群間比較を行った。プラセボ群に対するアメナリーフ群のハザード比とその両側95%信頼区間及びP値を算出し、両側P値が0.05より小さい場合に、プラセボに対するアメナリーフの優越性を検証できたと判断した。
また、主要評価項目に及ぼす特定の変数又は変数と投与群の交互作用の影響を確認するため、mITTを対象に、投与群及び背景因子※6を説明変数とし背景因子の交互作用を含むCox比例ハザード回帰分析を行い、背景因子の水準ごとの投与群のハザード比とその95%信頼区間及びP値、ならびに交互作用のP値を推定した。
※6 性別(男性/女性)、年齢[45歳未満/45歳以上、連続量(年齢/10)]、登録前1年間の性器ヘルペスの再発回数(4回未満/4回以上、連続量)、初期症状発現から治験薬服用までの時間(2時間以下/2時間超、連続量)、治験薬服用時点での臨床症状(紅斑・丘疹あり/なし、水疱・膿疱あり/なし、びらん・潰瘍あり/なし、紅斑・丘疹以外の臨床症状あり/なし)、治験薬服用時の「痛み(チクチク・ヒリヒリなど)」(あり/なし)
副次評価項目
性器ヘルペスのすべての病変部位が痂皮化するまでの時間、性器ヘルペスに伴う疼痛が消失するまでの時間及び性器ヘルペスに伴う自覚症状が消失するまでの時間については、Kaplan-Meier推定法によりデータを要約し、投与群を説明変数としたCox比例ハザード回帰分析を用いて群間比較を行った。
Aborted lesion症例の割合については、割合とその95%信頼区間(Wald法)を算出し、Fisherの正確確率検定を用いて割合の群間比較を行った。
安全性
ITTを対象に、治験薬服用後に認められた有害事象について、MedDRA/J ver.22.0のSOC、PTごとに集計を行った。
部分集団の検討
※7 性別(男性/女性)、年齢(45歳未満/45歳以上、65歳未満/65歳以上)、登録前1年間の性器ヘルペスの再発回数(0回以上4回未満/4回以上6回未満/6回以上)、ウイルス学的検査(陽性/陰性)、性器ヘルペス再発の初期症状発現から治験薬服用までの時間(1時間以内/1時間超、2時間以内/2時間超)、治験薬服用時点での臨床症状(主要評価項目では紅斑・丘疹あり/なし、水疱・膿疱あり/なし、びらん・潰瘍あり/なし、紅斑・丘疹以外の臨床症状あり/なし、Aborted lesion症例の割合では紅斑・丘疹あり/なし)、過去に経験した性器ヘルペス再発の初期症状(痛み/むずむずするような違和感/かゆみ/腰の痛みや違和感/その他)、治験薬服用時期(2020年3月以前/2020年4月以降)、治験薬服用時の痛み(あり/なし)
有効性
主要評価項目
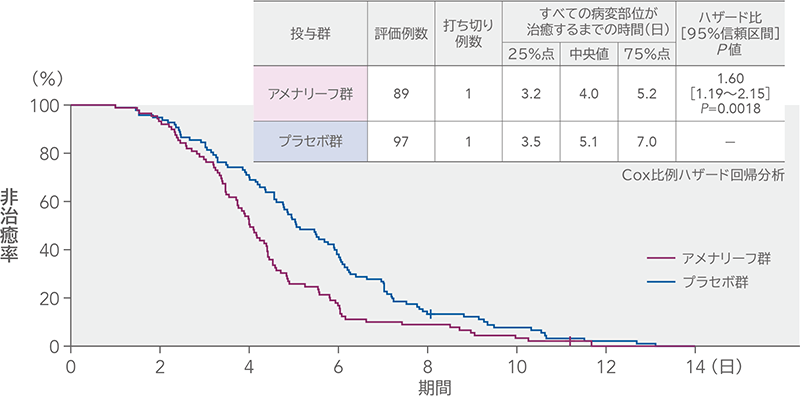
再発性の性器ヘルペスのすべての病変部位が治癒するまでの時間(mITT)(検証的解析結果)
再発性の性器ヘルペスのすべての病変部位が治癒するまでの時間の中央値は、アメナリーフ群4.0日、プラセボ群5.1日であり、中央値の差[95%信頼区間]は-1.05日[-1.74~-0.36日]であった。プラセボ群に対するアメナリーフ群のハザード比[95%信頼区間]は1.60[1.19~2.15]であり、アメナリーフ群が治癒するまでの時間を有意に短縮し、プラセボ群に対する優越性が検証された(P=0.0018、Cox比例ハザード回帰分析)。
副次評価項目
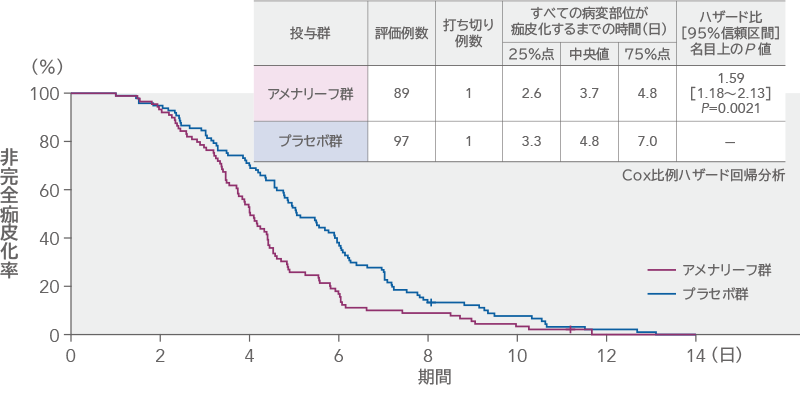
性器ヘルペスのすべての病変部位が痂皮化するまでの時間(mITT)
性器ヘルペスのすべての病変部位が痂皮化するまでの時間の中央値は、アメナリーフ群3.7日、プラセボ群4.8日であり、中央値の差[95%信頼区間]は-1.04日[-1.71~-0.37日]であった。プラセボ群に対するアメナリーフ群のハザード比[95%信頼区間]は1.59[1.18~2.13]であり、アメナリーフ群はプラセボ群と比較して痂皮化するまでの時間が有意に短いことが示された(名目上のP=0.0021、Cox比例ハザード回帰分析)。
副次評価項目
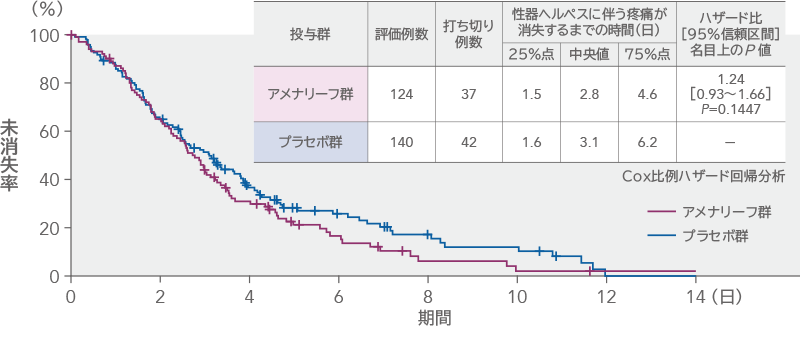
性器ヘルペスに伴う疼痛が消失するまでの時間(ITT)
性器ヘルペスに伴う疼痛が消失するまでの時間の中央値は、アメナリーフ群2.8日、プラセボ群3.1日であり、中央値の差[95%信頼区間]は
副次評価項目
Aborted lesion症例の割合(ITT)
Aborted lesion症例の割合[95%信頼区間]は、アメナリーフ群28.2%[20.3~36.1%]、プラセボ群30.0%[22.4~37.6%]で割合の群間差[95%信頼区間]は-1.8%[-12.7~9.2%]であり、群間差はなかった(名目上のP=0.6740、Fisherの正確確率検定)。
| 投与群 | 評価例数 | Aborted lesion症例 | 割合の群間差 [95%信頼区間]※1 |
名目上のP値※2 | |
|---|---|---|---|---|---|
| 例数 | 割合[95%信頼区間]※1 | ||||
| アメナリーフ群 | 124 | 35 | 28.2%[20.3〜36.1%] | -1.8%[-12.7〜9.2%] | 0.6740 |
| プラセボ群 | 140 | 42 | 30.0%[22.4〜37.6%] | − | − |
※1 Wald信頼区間
※2 Fisherの正確確率検定
副次評価項目
性器ヘルペスに伴う自覚症状が消失するまでの時間(Aborted lesion症例・サブグループ解析)
Aborted lesion症例を対象とした性器ヘルペスに伴う自覚症状が消失するまでの時間の中央値は、アメナリーフ群5.0日、プラセボ群3.6日であり、中央値の差[95%信頼区間]は1.38日[-0.05~2.81日]であった。プラセボ群に対するアメナリーフ群のハザード比[95%信頼区間]は0.70[0.39~1.28]で、群間差はなかった(名目上のP=0.2489、Cox比例ハザード回帰分析)。
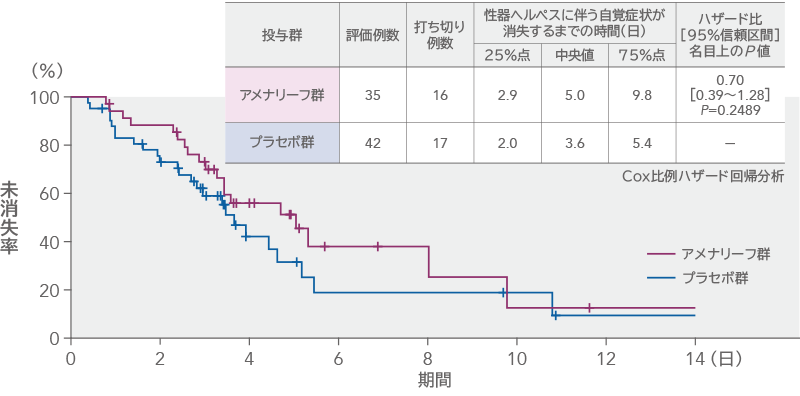
その他の有効性評価項目
紅斑・丘疹ありの患者の割合(Aborted lesion症例・サブグループ解析)
Aborted lesion症例においていずれかの時点で紅斑・丘疹ありの患者の割合は、アメナリーフ群71.4%(25/35例)、プラセボ群78.6%(33/42例)であった。
安全性
本試験における副作用※(安全性解析対象集団)
※ 治験薬に関連のある有害事象を副作用として取り扱った。
臨床検査値異常を含む副作用は、アメナリーフ群で124例中10例(8.1%)、プラセボ群で140例中13例(9.3%)に認められた。アメナリーフ群の主な副作用はβ-NアセチルDグルコサミニダーゼ増加3例(2.4%)、α1ミクログロブリン増加2例(1.6%)等であった。プラセボ群の主な副作用はα1ミクログロブリン増加3例(2.1%)、β-NアセチルDグルコサミニダーゼ増加及び尿中蛋白陽性各2例(各1.4%)等であった。死亡例を含む重篤な副作用は両群とも認められなかった。
本治験は単回投与試験のため、治験薬の投与中止に至った副作用は該当しなかった。
- 6. 用法・用量
- 〈帯状疱疹〉
通常、成人にはアメナメビルとして1回400mgを1日1回食後に経口投与する。 - 〈再発性の単純疱疹〉
通常、成人にはアメナメビルとして1200mgを食後に単回経口投与する。 - 7. 用法・用量に関連する注意(一部抜粋)
- 〈効能共通〉
〈再発性の単純疱疹〉7.1空腹時に投与するとアメナメビルの吸収が低下し、効果が減弱するおそれがあるので、食後に服用するよう患者に指導すること。食前又は食間のタイミングで服用する必要がある場合は、軽食等を摂取した上で服用させること。[16.2.1参照]7.4初期症状発現後速やかに本剤を服用することが望ましい。初期症状発現から6時間経過後に服用した患者、また口唇ヘルペスでは皮疹(水疱、 膿疱、びらん、潰瘍、痂皮)発現後に服用した患者に対する有効性を裏付けるデータは得られていない。[8.参照]7.5次回再発分の処方は1回分に留めること。
- 8. 重要な基本的注意
- 〈再発性の単純疱疹〉
次回再発分として処方する場合は、次のことを患者に十分説明し、患者が理解したことを確認すること。[7.4参照]- 初期症状(患部の違和感、灼熱感、そう痒等)出現後6時間以内に服用すること。また、口唇ヘルペスでは皮疹(水疱、膿疱、びらん、潰瘍、痂皮)発現前に服用すること。
- 妊婦又は妊娠している可能性のある女性、授乳中の女性は、服用せずに医療機関を受診すること。
社内資料:再発性の性器ヘルペス患者を対象とした第Ⅲ相臨床試験(M522101-J13試験)(承認時評価資料)



