ロゼックスの国内第Ⅲ相試験(酒さ)
社内資料:酒さ患者を対象とした第Ⅲ相臨床試験(M122101-01)(承認時評価資料)
試験デザイン
| 目的 | :酒さに伴う炎症性皮疹及び紅斑に対するロゼックスの有効性及び安全性を検討する。 |
|---|---|
| 試験デザイン | :ランダム化、二重盲検、プラセボ対照、並行群間、多施設共同、検証試験 |
| 対象 | :18歳以上の炎症性皮疹(丘疹・膿疱)及び紅斑を有する中等度以上(IGA(Investigator's Global Assessment)3 以上)の酒さ患者130例(FAS:最大の解析対象集団) |
| 方法 | :ロゼックス群又はプラセボ群に無作為に割り付け、1日2回(朝及び夜)、洗顔後又は入浴後に全顔の炎症性皮疹及び紅斑に適量塗布した。なお、炎症性皮疹及び紅斑が消失した場合も、治験責任(分担)医師から指示された部位(炎症性皮疹及び紅斑があった部位)に投与12週後(又は中止日)まで治験薬を継続塗布した。 |
有効性の評価項目
| 主要評価項目 | 投与12週後の炎症性皮疹数の変化率スコア*1及び紅斑重症度の変化スコア*1がともに3以上の被験者の割合 |
|---|---|
| 副次評価項目 | 投与12週後の炎症性皮疹数の変化率スコアが3以上の被験者の割合、投与12週後の紅斑重症度の変化スコアが3以上の被験者の割合、投与12週後にIGAが0又は1となった被験者の割合、炎症性皮疹数の変化率の経時推移、紅斑重症度*2の経時推移 |
| その他の評価項目 | 炎症性皮疹数の変化率スコア及び紅斑重症度の変化スコアがともに3以上の被験者の割合の経時推移、DLQI*3(Dermatology Life Quality Index)、Skindex-16*3など |
安全性の評価項目:有害事象、臨床検査値
*1 炎症性皮疹数の変化率スコア・紅斑重症度の変化スコア:ベースライン(治療開始日)、2、4、8、12週後に評価した。
| 炎症性皮疹数の変化率スコア | 紅斑重症度の変化スコア | ||
|---|---|---|---|
| スコア | 基準 | スコア | 基準 |
| 1 | -25%以上 | 1 | 悪化 |
| 2 | -26% ~ -50% | 2 | 不変 |
| 3 | -51% ~ -75% | 3 | 1段階改善 |
| 4 | -76% ~ -100% | 4 | 2段階以上改善 |
*2 紅斑重症度:事前検査日、ベースライン(治療開始日)、2、4、8、12週後に評価した。
| スコア | 重症度 | 定義 |
|---|---|---|
| 0 | 症状なし | 紅斑なし |
| 1 | 軽微 | 極めて淡い紅斑がある |
| 2 | 軽度 | 淡い紅斑がある |
| 3 | 中等度 | はっきりとした紅斑がある |
| 4 | 重度 | 重度の紅斑がある |
*3 DLQI(Dermatology Life Quality Index)、Skindex-16:ベースライン(治療開始日)及び12週後に評価した。
解析計画
| 主要評価項目 | 主要な解析として、FASを対象に、投与群ごとの例数及び割合、割合の95%信頼区間、群間差の推定値、標準誤差、群間差の95%信頼区間及びp値を算出した。群間比較はピアソンのカイ二乗検定(有意水準:両側5%)を用いて行い、欠測はWorst Observation Carried Forward(WOCF)で補完した。 |
|---|---|
| 副次評価項目 | これらの解析は副次的であるため、検定の際、複数項目間及び複数時点間の多重性は調整せず、有意水準は一律両側5%とした。 炎症性皮疹数の変化率の経時推移:FASを対象に、投与2週後以降の各Visitの炎症性皮疹数の変化率を応答変数、Visit、投与群及びVisit×投与群の交互作用を固定効果、治療開始日の炎症性皮疹数を共変量、Visit間の相関構造にUnstructured(無構造)を仮定した混合効果モデルを用いて解析した。 紅斑重症度の経時推移:FASを対象に、治療開始日以降の各Visitの紅斑重症度を応答変数、Visit間の相関構造にUnstructured(無構造)を仮定した混合効果モデルを用いて解析した。 |
| その他の評価項目 | その他の評価項目の解析は探索的であるため、検定の際は多群間の多重性及び時点間の多重性は調整せず、有意水準は一律両側5%とした。 |
結果
- 主要試験評価項目:投与12週後の炎症性皮疹数の変化率スコア及び紅斑重症度の変化スコアがともに3以上の被験者の割合
- 副次評価項目:炎症性皮疹数の変化率の経時推移
- 副次評価項目:紅斑重症度の経時推移
- その他の評価項目:Skindex-16(参考情報)
- 安全性
主要試験評価項目:
投与12週後の炎症性皮疹数の変化率スコア及び紅斑重症度の変化スコアがともに3以上の被験者の割合
投与12週後の時点で変化率スコア及び変化スコアがともに3以上の患者の割合は、ロゼックス群で72.3%(47/65 例)、プラセボ群で36.9%(24/65 例)であり、統計学的に有意な差が認められた(p<0.0001、ピアソンのカイ二乗検定)。
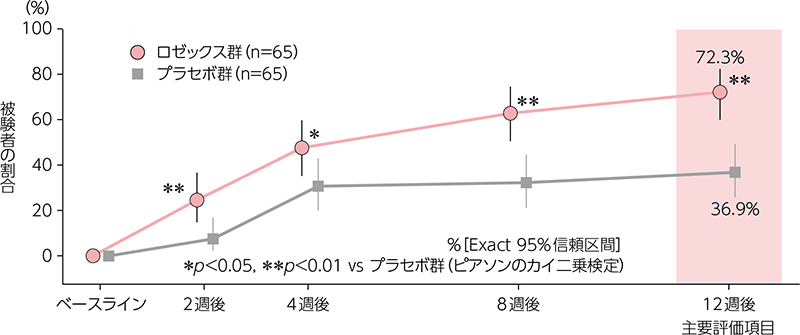
| ロゼックス群(n=65) | プラセボ群(n=65) | 群間差の推定値 | p値 | ||
|---|---|---|---|---|---|
| 2週後 | 16(24.6%) [14.8,36.9] |
5(7.7%) [2.5, 17.0] |
16.9% [-1.0, 34.1 |
0.0088 | |
| 4週後 | 31(47.7%) [35.1, 60.5] |
20(30.8%) [19.9, 43.4] |
16.9% [-1.0, 34.1] |
0.0482 | |
| 8週後 | 41(63.1%) [50.2, 74.7] |
21(32.3%) [21.2, 45.1] |
30.8% [13.1, 47.0] |
0.0004 | |
| 12週後 | 47(72.3%) [59.8, 82.7] |
24(36.9%) [25.3, 49.8] |
35.4% [17.9, 51.3] |
<0.0001 | 主要評価項目 |
副次評価項目:
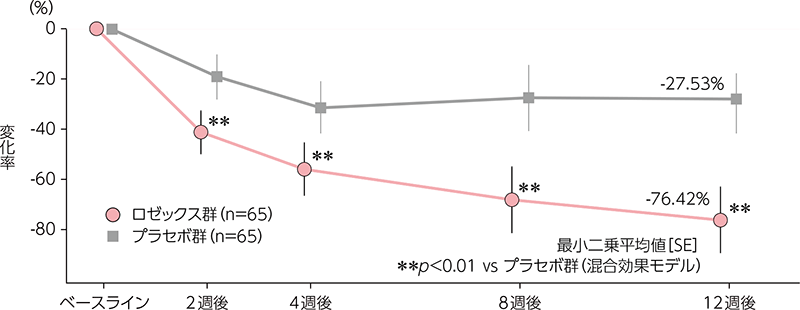
炎症性皮疹数の変化率の経時推移
ロゼックス群では炎症性皮疹数が経時的に減少し、投与2週後、4週後、8週後及び12週後にプラセボ群に対して統計学的に有意な差が認められた(p<0.01、混合効果モデル)。
副次評価項目:
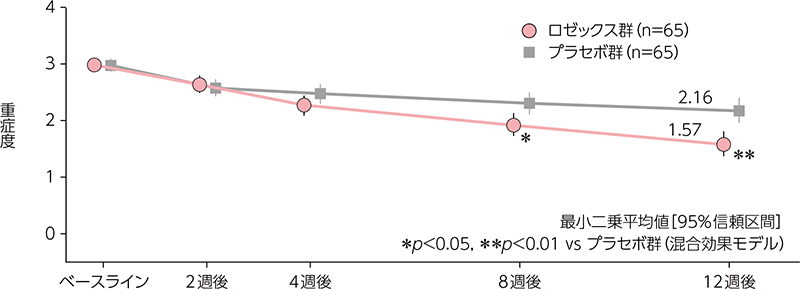
紅斑重症度の経時推移
ロゼックス群では紅斑重症度が経時的に減少し、投与8週後以降にプラセボ群に対して統計学的に有意な差が認められた(投与8週後:p<0.05、投与12 週後:p<0.01、混合効果モデル)。
その他の評価項目:Skindex-16(参考情報)
投与12週後の時点で合計スコアが10以上変化した患者の割合は、ロゼックス群で82.7%(43/52例)、プラセボ群で55.2%(32/58 例)であり、ロゼックス群で統計学的に有意な差が認められた(p=0.0020、ピアソンのカイ二乗検定)。
(FAS(ベースラインのSkindex-16 合計スコアが10 以上の被験者))
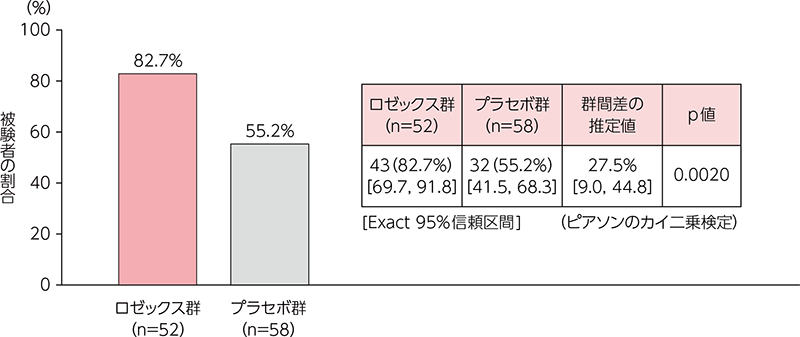
社内資料:酒さ患者を対象とした第Ⅲ相臨床試験(M122101-01)(承認時評価資料)より作図
- 2. 禁忌(次の患者には投与しないこと) 一部抜粋
- 2.3 妊娠3ヵ月以内の女性[9.5.1、16.3.2参照]
- 6. 用法・用量 一部抜粋
- <酒さ>
1日2回、患部を洗浄後、適量を塗布する。 - 7. 用法・用量に関連する注意
- <酒さ>
7.1 本剤の使用期間は通常12週間までとすること。12週間を超えて使用する場合には、その必要性を慎重に判断し、漫然と使用しないこと。国内臨床試験では、12週間の投与による有効性及び安全性が確認されている。 - 15. その他の注意 一部抜粋
- 15.2 非臨床試験に基づく情報
15.2.1 長期経口投与により、マウスでは肺腫瘍が、またラットでは乳房腫瘍の発生が報告されているが、ハムスターの生涯投与試験では腫瘍はみられていないとの報告がある。[8.3参照]
安全性
本試験において、副作用の発現頻度は、ロゼックス群が9.2%(6/65 例)、プラセボ群が6.2%(4/65 例)であった。
ロゼックス群の副作用は、接触皮膚炎が3.1%(2/65 例)、乾燥1.5%(1/65 例)、そう痒1.5%(1/65 例)、つっぱり感1.5%(1/65 例)、皮脂欠乏症1.5%(1/65 例)で、プラセボ群の副作用は、酒さ3.1%(2/65 例)、接触皮膚炎1.5%(1/65 例)、適用部位不快感1.5%(1/65 例)であった。
死亡及び重篤な副作用は認められなかった。
治験薬の投与中止に至った副作用はそれぞれの群で接触皮膚炎が1例であった。



